

Surveillance of adverse
events following
immunisation in NSW 2021
5 April 2023
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 1 of 28
Contents
Contents ............................................................................................................................................ 2
Abbreviations ..................................................................................................................................... 3
Abstract .............................................................................................................................................. 4
Introduction ........................................................................................................................................ 5
Methods ............................................................................................................................................. 6
AEFI data .................................................................................................................................... 6
Reported deaths .......................................................................................................................... 7
Serious and non-serious AEFI .................................................................................................... 7
Data analysis ............................................................................................................................... 7
Notes on interpretation ................................................................................................................ 8
Results ............................................................................................................................................... 9
Reporting rate ............................................................................................................................. 9
Age distribution ........................................................................................................................... 9
Vaccines ...................................................................................................................................... 9
Adverse events ......................................................................................................................... 10
Serious adverse events ............................................................................................................. 10
Death fol owing vaccination ....................................................................................................... 10
Discussion ....................................................................................................................................... 11
Conclusion .................................................................................................................................... 12
Acknowledgement ........................................................................................................................ 12
References ...................................................................................................................................... 13
Tables .............................................................................................................................................. 15
Figures ............................................................................................................................................. 19
Supplementary Material ................................................................................................................... 25
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 2 of 28
Abbreviations
13vPCV
13-valent pneumococcal conjugate vaccine
23vPPV
23-valent pneumococcal polysaccharide vaccine
7vPCV
7-valent pneumococcal conjugate vaccine
AEFI
adverse event following immunisation
AEMS
Adverse Event Management System
CI
confidence interval
DAEN
Database of Adverse Event Notifications
DTPa
diphtheria-tetanus-pertussis (acellular) – paediatric formulation
dTpa
diphtheria-tetanus-pertussis (acellular) – adolescent and adult formulation
combined diphtheria-tetanus-pertussis (acellular) and Haemophilus
DTPa-Hib
influenzae type b vaccine
combined diphtheria-tetanus-pertussis (acellular) and inactivated
DTPa-IPV
poliovirus (quadrivalent) – paediatric formulation
combined diphtheria-tetanus-pertussis (acellular), inactivated poliovirus,
DTPa-IPV-HepB-Hib
hepatitis B and Haemophilus influenzae type b vaccine (hexavalent)
combined diphtheria-tetanus-pertussis (acellular) and inactivated
dTpa-IPV
poliovirus (quadrivalent) – adolescent and adult formulation
H1N1pdm09
pandemic H1N1 influenza 2009
HepB
hepatitis B
Hib
Haemophilus influenzae type b
combined Haemophilus influenzae type b and meningococcal C
Hib and MenC
conjugate vaccine
combined Haemophilus influenzae type b and meningococcal C and Y
Hib and MenCY
conjugate vaccine
Hib-HepB
combined Haemophilus influenzae type b and hepatitis B
HPV
human papil omavirus
quadrivalent meningococcal (serogroups A, C, W-135, Y) conjugate
MenACWY
vaccine
MenB
meningococcal B vaccine
MenC
meningococcal C conjugate vaccine
MMR
measles-mumps-rubel a
MMRV
measles-mumps-rubel a-varicella
NCIRS
National Centre for Immunisation Research and Surveil ance
NIP
National Immunisation Program
PT
preferred terms
SMQ
standardised MedDRA query
TGA
Therapeutic Goods Administration
WHO
World Health Organization
Zoster (RZV)
recombinant zoster vaccine
Zoster (ZVL)
live-attenuated zoster vaccine
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 3 of 28
Abstract
Aim: This report summarises Australia’s spontaneous surveil ance data for adverse events following
immunisation (AEFI) with non-COVID-19 vaccines in New South Wales (NSW) for 2021.
Methods: Analysis of de-identified data on all AEFI reported to the Therapeutic Goods
Administration (TGA) for NSW, where AEFI are defined as any untoward medical occurrence that
fol ows immunisation. This report excludes AEFI reports including pandemic COVID-19 vaccines,
which are reported separately.
Results: There were 618 AEFI reports for vaccines administered from 1 January to 31 December
2021. The overal AEFI reporting rate of 7.5 [95% CI 7.0–8.2] per 100,000 population in 2021 is
lower compared with 9.6 [95% CI 9.0–10.3] per 100,000 population in 2020. Approximately 15% of
AEFI were classified as serious in 2021. The majority of reported events were of a non-serious
nature, similar to previous years. Overall, reported adverse events were most commonly associated
with the fol owing vaccines: standard-formulation seasonal influenza (29.6%), 13vPCV (19.3%),
DTPa-IPV-HepB-Hib (13.3%), DTPa-IPV (9.9%), rotavirus (9.7%), and high-dose or adjuvanted
seasonal influenza (9.5%). The most frequently reported adverse events were hypersensitivity (122),
injection site reaction (104), pyrexia (104), gastrointestinal nonspecific symptoms and therapeutic
procedures (77), and headache (46). Five deaths were reported in this period, and for all five cases,
the TGA did not establish a causal link between vaccination and the condition that caused the death.
Conclusion: The reporting rate for AEFI from NSW in 2021 was lower than the AEFI reporting rate
in 2020. The majority of AEFI reported to the TGA from NSW were non-serious and no deaths
fol owing vaccination had a causal relationship with vaccination. These data are useful to inform
ongoing immunisation programs in NSW.
This report is a deliverable under contract with Health Protection NSW in relation to services for
immunisation research and surveillance, and has been prepared by Catherine Glover, Lucy Deng,
Frank Beard, Kristine Macartney, and Nicholas Wood at the National Centre for Immunisation
Research and Surveil ance (NCIRS); Sonya Ennis, Paola Garcia, and Eve Wu at Health Protection
NSW; and Claire Larter, Elspeth Kay, and Catherine Brogan at the Therapeutic Goods
Administration. We would also like to acknowledge and thank Aditi Dey, Han Wang, Alexandra
Hendry, and Tristan Franks at NCIRS for providing historical context and code and vaccine dose
data from the Australian Immunisation Register.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 4 of 28
Introduction
This report summarises spontaneous (passive) adverse event following immunisation (AEFI)
surveil ance data reported for non-COVID-19 vaccines administered in 2021 in New South Wales
(NSW) and trends in AEFI reporting over the 22-year period 2000–2021.
An adverse event(s) fol owing immunisation (AEFI) is defined as any untoward medical occurrence
which fol ows immunisation and which does not necessarily have a causal relationship with the
usage of the vaccine.(1) The AEFI may be an unfavourable or unintended sign, abnormal laboratory
finding, symptom or disease. AEFI can be a coincidental event or caused by the vaccine(s) and can
be classified into the following categories:(1)
1. Vaccine product-related reaction
2. Vaccine quality defect-related reaction
3. Immunisation error-related reaction
4. Immunisation anxiety-related reaction
5. Coincidental event.
Ongoing post-marketing AEFI surveil ance through a national spontaneous surveil ance system is
important in detecting unexpected AEFI that may not have been detected in pre-registration vaccine
trials.
AEFI are notifiable to NSW public health units by medical practitioners and hospital chief executive
officers under the
Public Health Act 2010 (NSW). Cases with any missing information and al serious
AEFI are followed up by public health units and Health Protection NSW. All notifications are
forwarded to the Therapeutic Goods Notification (TGA). The TGA also receives reports directly from
vaccine manufacturers, members of the public and other sources.(2) All reported AEFI are entered
into the Australian Adverse Event Management System (AEMS) database. Where the initial report
contains insufficient information, depending on the origin of the report, the TGA may contact the
reporter directly, Health Protection NSW to elicit further information from the reporter via local public
health units depending on the source of the report. The TGA continual y analyses AEFI data to
detect new potential safety issues or changes to known safety issues that may require regulatory
action. Select serious adverse events are assessed for causality using international y consistent
criteria to identify whether there may be a link between the medical condition(s) involved and
vaccination that indicates potential new safety information.
Trends in reported AEFI are influenced by many factors, including changes to the National
Immunisation Program (NIP), vaccine introduction and availability, media coverage, awareness
campaigns, and efforts to facilitate reporting. Changes to the NIP since 2005 are summarised in
Table S1, and their impacts on reported AEFI trends are described in previous reports.(3-13) There
were no changes to the NIP or vaccine availability in 2021 to highlight.
This report summarises national spontaneous (passive) surveil ance data for NSW non-COVID-19
vaccine AEFI reported to the TGA. The report focuses on AEFI reported for vaccines administered in
2021 and trends in AEFI reporting over the 22-year period 1 January 2000 – 31 December 2021.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 5 of 28
Methods
AEFI data
De-identified data on all AEFI reported to the TGA from 1 January 2000 to 31 December 2021 and
stored in the AEMS database were released to the National Centre for Immunisation Research and
Surveil ance (NCIRS) in May 2022. Please refer to previous reports for a detailed description of the
surveil ance system.(3, 14)
AEFI reports with a patient state of NSW were included in analysis. Where the patient state was
missing, the sender (reporter) state was used; where sender state was missing, the sender postcode
was used.
Vaccine data
Vaccines were identified by trade name (standardised term in the TGA reference dataset), and
where the trade name was not specified, the generic name (active ingredients associated with a
trade name) and reported product name (product name used by the reporter). Individual vaccines
were grouped by antigen and, for seasonal influenza and zoster vaccines, by type (for influenza,
standard-formulation vs high-dose or adjuvanted; for zoster, live virus vs recombinant adjuvanted).
Only vaccines with a role in relation to the reported adverse event of ‘suspect’ were included in
analysis. In addition, only accepted reports were included. To be accepted, the report must contain
sufficient information to be valid, which includes four key elements: a reporter, a patient, one or more
suspected vaccines, and one or more reaction terms. Valid reports are accepted by the TGA with a
default decision type of ‘causality possible’. Reports that included both non-COVID-19 and COVID-
19 vaccines as ‘suspect’ are included in the COVID-19 vaccine AEFI report and were excluded from
this analysis.
Adverse event data
AEFI reports include reaction terms that are symptoms, signs and/or diagnoses that have been
coded by TGA staff from the reporter’s description into lower level terms, which are mapped to
associated preferred terms (PT) using the Medical Dictionary for Regulatory Activities
(MedDRA®).(15, 16)
Standardised MedDRA queries (SMQ) are sets of MedDRA terms that have been grouped after
extensive testing, analysis, and expert discussion to facilitate pharmacovigilance investigation(17).
For this analysis, the MedDRA Browser SMQ Analysis tool was used to group related PT to their
SMQ to reduce the number of unique PT under analysis while providing meaningful results. As
individual PT may map to zero, one, or more than one SMQ, the term reported was chosen as
described in Table S2.
The PT/SMQ were numerical y ranked by frequency, and the 50 most frequent PT/SMQ were
reported, with ties determined using the minimum method (i.e. PT/SMQ reported the same number
of times received the same minimum ranking possible).
AEFI report data
AEFI reports were defined by unique identifiers provided by the TGA. Each report was assigned a
date based on the earliest vaccine date associated with the report; where a vaccine date was
missing, the earliest symptom onset date was used; and where dates for both vaccine and symptom
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 6 of 28
onset were missing, the received date (the date when the sender of the case first received the
minimum valid information as described above from the primary source) was used. Where the date
of birth was available, it was used to calculate age at time of vaccination, symptom onset, or
received date; where it was missing, the age at symptom onset provided by the TGA was used.
Reports were grouped by age into <7 years, 7-17 years, 18-64 years, and ≥65 years. Reports with a
vaccination, symptom onset, or received date (as described above) prior to 2021 were excluded
from the 2021 specific analysis.
Reported deaths
All AEFI reports where a fatal outcome is reported are reviewed by the TGA. This review is designed
to assess whether the medical condition(s) that caused death represent an emerging safety concern
with a vaccine. For each report the TGA receives, a team of staff, including doctors and nurses,
consider the strength of the evidence for a link between vaccination and the condition that caused
the death using a standardised process based on the World Health Organization (WHO)
guidelines.(18) When another cause for the events that resulted in death is not medical y obvious,
not stated and cannot be determined from the initial report, the TGA may request further information,
depending on the origin of the report, from the reporter directly or from Health Protection NSW. This
may include the results of investigations relating to the diagnosed cause of death or past medical
history, post-mortem examination findings, the death certificate, and/or results of a Coronial Office
investigation. Even when the TGA does not have sufficient information to confirm a causal link
between a cause of death and vaccination, each case is stil recorded in the DAEN as "Causality
Possible", The TGA continues to review new information about the case as it arises, including
Coronial findings that may be released sometime after the initial report is received.
Serious and non-serious AEFI
AEFI reports are coded as ‘serious’ or ‘non-serious’ based on criteria used by the WHO(19) and the
US Vaccine Adverse Events Reporting System,(20) where an adverse event report is defined as
‘serious’ if it meets one or more of the following criteria:
1. Results in death
2. Is life-threatening
3. Requires inpatient hospitalisation or prolongation of existing hospitalisation
4. Results in persistent or significant disability/incapacity
5. Is a congenital anomaly/birth defect
6. Is a medically important event or reaction.
The seriousness classification is applied by Australian sponsors (vaccine companies) to vaccine
AEFI reports to ensure they meet legislated requirements. For other AEFI reports submitted to the
TGA, the seriousness classification either reflects the view of the reporter or may have been applied
fol owing review by the TGA.
Data analysis
All data cleaning and analyses were performed using R version 4.0.3. Average annual population-
based AEFI reporting rates were calculated for NSW and by age group using June 2021 population
estimates obtained from the Australian Bureau of Statistics.(21) AEFI reporting rates per 100,000
administered doses were estimated where information was available on the number of doses
administered. The number of administered doses of each of the vaccines given was obtained from
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 7 of 28
the Australian Immunisation Register (AIR), a national population-based register.(22) Confidence
intervals presented are 95% exact binomial confidence intervals for proportions.
AEFI reports fol owing COVID-19 vaccination have been analysed and wil be presented in a
separate report.
Notes on interpretation
The data reported here are provisional, particularly for the fourth quarter of 2021 due to reporting
delays and the late onset of some reported AEFI. In addition, AEFI may have been reported in 2021
for vaccinations occurring in previous years. Numbers have therefore been updated for previous
years and may not match previous reports.
In previous reports, where patient or sender state was missing, the report was excluded from the
analysis. This report includes AEFI reports where sender postcode is from NSW, which has resulted
in higher number of AEFI reports included in the analysis and a change in AEFI reporting rates for
previous years. AEFI reporting frequencies and rates in this report should therefore not be directly
compared to previous reports.
As this report analyses data from the AEMS database, the numbers published in this report may be
different to the numbers found the Database of Adverse Event Notifications (DAEN) – medicines, a
public online database maintained by the TGA that contains reports of adverse events for all
medicines and vaccines.(23) The AEMS database includes more detailed information on each AEFI
report and incorporates amendments and updates to reports when additional information is made
available to the TGA. As the data for this analysis was extracted from AEMS in May 2022, there may
be discrepancies with the DAEN – medicines, which is a live database that reflects new information
made available to the TGA.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 8 of 28
Results
There were 618 reports in the AEMS database where the date of vaccination (or onset of adverse
event or received date, if vaccination date was not reported) was between 1 January and 31
December 2021. Of reports with sex reported (N=595), 358 (60.2%) were in females and 237
(39.8%) were in males; 23 reports (3.7% of total) did not report sex. Of reports with Indigenous
status reported (N=92), 39 AEFI reports (42.4%) were for people identified as Aboriginal and/or
Torres Strait Islander; Indigenous status was not reported in 526 reports (85.1%).
Of reports with age or date of birth reported (N=598), 268 (44.8%) were for children aged <7 years
and 330 (55.2%) were for people aged ≥7 years, while 20 AEFI reports (3.2% of total) did not report
age information.
Approximately half (306, 49.5%) of AEFI reports were reported by the state health department
(representing notifications reported to NSW Health via public health units), while 34.8% (215) were
reported by health professionals, 12.0% (74) were reported by consumers and 3.4% (21) were
reported by pharmaceutical companies. There was one report sent by a regulatory authority and one
by a distributor or other organisation.
There were 70 reports excluded from this analysis where suspect non-COVID-19 vaccines were
reported together with suspect COVID-19 vaccines; these are included in the separate COVID-19
vaccine AEFI report.
Reporting rate
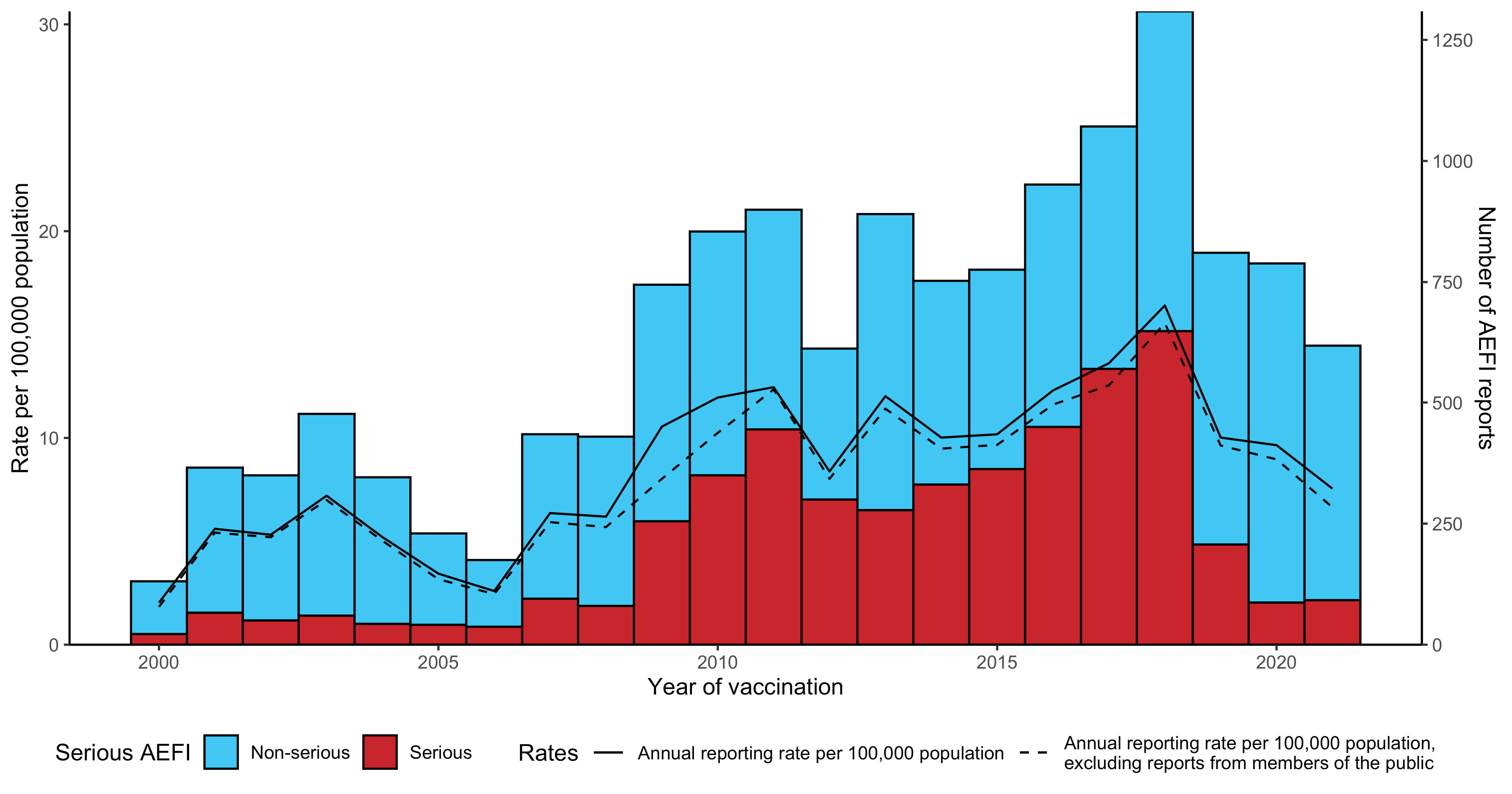
The overal AEFI reporting rate for 2021 was 7.5 [95% CI 7.0–8.2] per 100,000 population compared
with 9.6 [95% CI 9.0–10.3] per 100,000 in 2020 and 10.0 [95% CI 9.3–10.7] per 100,000 in 2019
(Figure 1). The majority of reported events (85.1%) in 2021 were coded as non-serious.
Figures 2-5 demonstrate variations in AEFI reporting for vaccines in people aged <7, 7-17, 18-64
and ≥65 years associated with changes to the NIP from 2000 onwards. The decrease in reports in
2021 compared with 2020 was mainly attributable to fewer AEFI reports fol owing a >30% reduction
in the number of AEFI reports following 23vPPV, HPV vaccine, MMRV, dTpa, and standard-
formulation seasonal influenza vaccine. The highest numbers of AEFI reports in 2021 followed
standard-formulation seasonal influenza vaccine in people aged 18-64 years (Table 1, Figure 4),
and 13vPCV, DTPa-IPV-HepB-Hib, rotavirus vaccine and DTPa-IPV in children aged <7 years
(Table 1, Figure 2).
Age distribution
The highest age-specific AEFI reporting rate per 100,000 population occurred in children aged <7
years (Figure 6). Compared with 2020, reporting rates of AEFI decreased in all age groups in 2021
(Figure 6).
Vaccines
The vaccine most frequently reported in 2021 AEFI reports was standard-formulation seasonal
influenza vaccine (183 reports; 29.6% of total), fol owed by 13vPCV (119 reports; 19.3%), DTPa-
IPV-HepB-Hib (82 reports; 13.3%), DTPa-IPV (61 reports; 9.9%) and rotavirus vaccine (60 reports;
9.7%) (Table 2). Of the 183 AEFI reports fol owing standard-formulation seasonal influenza
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 9 of 28
vaccination, 24 (13.1%) were classified as serious and 37 (20.2%) were reported in children aged <7
years (Table 2).
Adverse events
The most frequently reported PT or SMQ in 2021 were hypersensitivity (122 reports; 19.7%),
injection site reactions (104 reports; 16.8%), pyrexia (104 reports; 16.8%), gastrointestinal non-
specific symptoms and therapeutic procedures (77 reports; 12.5%) and headache (46 reports; 7.4%)
(Table 3).
Serious adverse events
The proportion of AEFI reports where the outcome was categorised as serious remained low in 2021
with 14.9% of al AEFI reports coded as serious. The proportion of serious AEFI reports for the
vaccines with the highest numbers of serious reports were: 24/183 (13.1%) following standard-
formulation seasonal influenza vaccine, 23/119 (19.3%) fol owing 13vPCV, 18/60 (30.0%) following
rotavirus vaccine, 18/82 (22.0%) following DTPa-IPV-HepB-Hib, 13/59 (22.0%) fol owing high-dose
or adjuvanted seasonal influenza vaccine, and 9/51 (17.6%) following MMR (Table 3).
Death following vaccination
Five adverse events with a fatal outcome were reported to the TGA from NSW where the reporter
considered a causal link between vaccination and the event was possible. Fol owing assessment,
the TGA did not receive sufficient information to establish a causal link between vaccination and the
condition that caused the death for any of the five cases, however the TGA stil recorded these
cases as “causality possible” and wil continue to consider new information about these cases as it
arises. There were three cases in adults aged >70 years who died fol owing complications of their
existing underlying medical conditions. There were two cases in children: one case who died of
complications from COVID-19 infection and one who died from a congenital condition.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 10 of 28
Discussion
In 2021, there was a decrease in both the number of AEFI reports and the overal AEFI reporting
rate compared with the previous years, consistent with national AEFI reporting rate trends (24, 25).
While 70 AEFI reports with both non-COVID-19 and COVID-19 vaccines were excluded from this
analysis, the number of AEFI reports and overall AEFI reporting rate with the inclusion of these
reports (688 reports; 8.4 per 100,000 population) is stil lower than for 2020 (788 reports; 9.6 per
100,000 population, Figure 1). This decrease in the AEFI reporting rate in 2021 could be related to
the focus on COVID-19 vaccines and therefore AEFI reporting for COVID-19 vaccines in 2021.
In children aged <7 years, there was a decrease in the number of AEFI reports for all vaccines
except MenB and MMR. The increased number of AEFI reports following MenB reflects increased
AEFI reporting that typical y occurs after a vaccine is introduced to the NIP.(4-6, 8, 11, 12, 24, 26-
32) MenB was funded for Aboriginal and Torres Strait Islander children aged <12 months and
individuals of any age with specified high-risk medical conditions from 2020 (Table S1). While the
number of AEFI reports fol owing MMR increased in 2021 compared to 2020, it remains within the
range of AEFI reports fol owing MMR over the past 20 years.
Among people aged 7 to 17 years, there was also a decrease in the number of AEFI reports for al
vaccines. The decrease in AEFI reports may be a reflection of modestly lower vaccine uptake(33),
possibly as a result of ongoing impacts of COVID-19 restrictions and/or infection delaying
vaccinations or access to vaccinations via school-based programs.(34) The AEFI reporting rate for
MenACWY in this age group (13.8 per 100,000 doses [95%CI 6.3–26.3]) has decreased and
stabilised following vaccine program introduction and comparatively high AEFI reporting rates (29.2
per 100,000 doses [95%CI 20.3–40.6]) in 2018.(35)
In people aged 18 to 64 years, the majority of AEFI reports fol owed standard-formulation seasonal
influenza vaccine while in people aged ≥65 years, high-dose or adjuvanted seasonal influenza
vaccine had the highest number of AEFI reports, reflecting the vaccination recommendations for
both age groups. Increased AEFI reports following high-dose or adjuvanted seasonal influenza
vaccine in people aged ≥65 years may be a result of higher vaccine coverage in this age group in
2021 compared to 2020.(33)
Overal , the three most commonly reported AEFI in NSW were hypersensitivity (19.7%), injection
site reactions (16.8%) and pyrexia (16.8%), consistent with previous years and with national AEFI
reporting. While the proportion of serious AEFI reports in NSW was higher compared to Australia as
a whole (14.9% vs 6.5%), the difference is likely a result of fewer reports of non-serious AEFI in
NSW rather than a higher-than-expected number of serious AEFI, as the serious AEFI reporting rate
in NSW is similar compared to the national rate (1.1 vs 0.9 per 100,000 population). Finally, of the
five deaths fol owing vaccination, none were considered to be causal y related to vaccination
fol owing detailed review of individual reports by TGA staff.
These national spontaneous surveil ance data are complemented by AusVaxSafety, an active
sentinel vaccine safety surveil ance system, that also monitors the safety of vaccines used in the
NIP.(36) While the data from both systems cannot be directly compared due to differences in
methodology, they provide complementary data on the safety of vaccines used in Australia.
There are some limitations to this analysis. AEFI reports can vary significantly in the amount of
detail, completeness, and quality of information, and are not always verified against clinical notes.
AEFI reports can include multiple vaccines, vaccination dates, AEFI, and AEFI onset dates. Based
on the information provided, it not always possible to associate specific vaccines to specific AEFI
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 11 of 28
and AEFI onset dates. The seriousness criteria for AEFI reports can be applied differently based on
the report source and is not always based on verified clinical data, so it may not capture all medically
important events, and in addition may capture non-serious events; therefore, the seriousness
classification of an AEFI report cannot be directly interpreted as an indicator of safety. While AEFI
reporting rates can be estimated, they cannot be interpreted as incidence rates due to potential
under-reporting, biased reporting, stimulated reporting (from increased awareness of potential
adverse events of vaccines newly introduced to the NIP or covered in the media), and the variable
quality and completeness of information provided in individual notifications.(3-8, 11-14, 26, 37-39)
Indigenous status is not always reported in all AEFI reports and therefore AEFI rates in Aboriginal
and Torres Strait Islander people are likely to be biased. Final y, the AEFI reported here are not
necessarily causally related to vaccination. The TGA strongly encourages consumers and health
professionals to report suspected adverse events, even if there is only a very small chance a
vaccine was the cause. With large scale vaccination programs, it is inevitable by chance that some
people wil experience a new il ness or die within a few days or weeks of vaccination. These events
are often coincidental, rather than being caused by the vaccine.
Conclusion
Overal , AEFI reporting rates for non-COVID-19 vaccines decreased in 2021 compared with 2020,
with the majority of reported AEFI being common, expected adverse events. The data reported here
are consistent with an overall high level of safety for vaccines included in the NIP schedule when
administered according to clinical recommendations.
Acknowledgement
This report is a deliverable under contract with NSW Health in relation to services for immunisation
research and surveil ance, and has been prepared by Catherine Glover, Lucy Deng, Frank Beard,
Kristine Macartney, and Nicholas Wood at the National Centre for Immunisation Research and
Surveil ance (NCIRS). We would also like to acknowledge and thank Aditi Dey, Han Wang,
Alexandra Hendry, and Tristan Franks at NCIRS for providing historical context and code and
vaccine dose data from the Australian Immunisation Register.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 12 of 28
References
1.
Council for International Organizations of Medical Sciences (CIOMS) c/o World Health
Organization. Definition and Application of Terms for Vaccine Pharmacovigilance: Report of
CIOMS/WHO Working Group on Vaccine Pharmacovigilance. 2012.
2.
Australian Technical Advisory Group on Immunisation (ATAGI). Australian Immunisation
Handbook, Australian Government Department of Health, Canberra 2018 [Available from:
https://beta.health.gov.au/resources/publications/the-australian-immunisation-handbook.
3.
Lawrence G, Boyd I, McIntyre P, Isaacs D. Surveil ance of adverse events following
immunisation: Australia 2002 to 2003. Commun Dis Intell. 2004;28(3):324-38.
4.
Lawrence G, Boyd I, McIntyre P, Isaacs D. Annual report: surveil ance of adverse events
fol owing immunisation in Australia, 2005. Commun Dis Intel . 2006;30(3):319-33.
5.
Lawrence G, Gold MS, Hil R, Deeks S, Glasswel A, McIntyre PB. Annual report:
surveil ance of adverse events following immunisation in Australia, 2007. Commun Dis Intell.
2008;32(4):371-87.
6.
Lawrence GL, Aratchige PE, Boyd I, McIntyre PB, Gold MS. Annual report on surveil ance of
adverse events following immunisation in Australia, 2006. Commun Dis Intell. 2007;31(3):269-82.
7.
Lawrence GL, Boyd I, McIntyre PB, Isaacs D. Annual report: surveil ance of adverse events
fol owing immunisation in Australia, 2004 Commun Dis Intel . 2005;29(3):248-62.
8.
Menzies R, Mahajan D, Gold MS, Roomiani I, McIntyre P, Lawrence G. Annual report:
surveil ance of adverse events following immunisation in Australia, 2008. Commun Dis Intell.
2009;33(4):365-81.
9.
Mahajan D, Campbell-Lloyd S, Cook J, Menzies R. NSW annual report describing adverse
events following immunisation, 2010. NSW Public Health Bulletin. 2011;22(9-10):196-208.
10.
Mahajan D, Campbel -Lloyd S, Roomiani I, Menzies R. NSW Annual Adverse Events
fol owing immunisation report, 2009. NSW Public Health Bul etin. 2010;21(9-10):224-33.
11.
Mahajan D, Cook J, Dey A, Macartney K, Menzies RI. Annual report: surveil ance of adverse
events following immunisation in Australia, 2011. Commun Dis Intell. 2012;36(4):E315-32.
12.
Mahajan D, Cook J, McIntyre PB, Macartney K, Menzies RI. Annual report: surveil ance of
adverse events following immunisation in Australia, 2010. Commun Dis Intell. 2011;35(4):263-80.
13.
Mahajan D, Reid S, Cook J, Macartney K, Menzies R. NSW annual report describing
adverse events following immunisation, 2011. NSW Public Health Bulletin 2012. 2012;23(9-10):187-
200.
14.
Lawrence G, Menzies R, Burgess M, McIntyre P, Wood N, Boyd I, et al. Surveil ance of
adverse events following immunisation: Australia, 2000–2002. Commun Dis Intell. 2003;27(3):307-
23.
15.
Brown EG. Using MedDRA: implications for risk management. Drug Saf. 2004;27(8):591-
602.
16.
Brown EG, Wood L, Wood S. The medical dictionary for regulatory activities (MedDRA).
Drug Saf. 1999;20(2):109-17.
17.
Medical Dictionary fo Regulatory Agencies. Standardised MedDRA Queries 2023 [Available
from: https://www.meddra.org/standardised-meddra-queries.
18.
World Health Organisation. Causality assessment of an adverse event fol owing
immunization (AEFI): user manual for the revised WHO classification, 2nd ed., 2019 update. World
Health Organisation; 2021.
19.
Uppsala Monitoring Centre. WHO Col aborating Centre for International Drug Monitoring.
[Available from: http://www.who-umc.org/.
20.
Zhou W, Pool V, Iskander JK, English-Bul ard R, Bal R, Wise RP, et al. Surveil ance for
safety after immunization: Vaccine Adverse Event Reporting System (VAERS)--United States, 1991-
2001. [erratum appears in MMWR Morb Mortal Wkly Rep. 2003 Feb 14;52(06):113]. MMWR Surveil
Summ. 2003;52(1):1-24.
21.
Australian Bureau of Statistics. National, state and territory population Canberra2022
[Available from: https://www.abs.gov.au/statistics/people/population/national-state-and-territory-
population/jun-2021.
22.
Australian Government Department of Human Services. Australian Immunisation Register
[Available from: https://www.humanservices.gov.au/customer/services/medicare/australian-
immunisation-register.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 13 of 28
23.
Australian Government Department of Health, Therapeutic Goods Administration. Database
of Adverse Event Notifications. [Available from: http://www.tga.gov.au/safety/daen.htm.
24.
Dey A, Wang H, Quinn H, Pil sbury A, Glover C, Hickie M, et al. Surveil ance of adverse
events following immunisation in Australia annual report, 2019. Communicable diseases intelligence
(2018). 2021;45.
25.
Dey A, Wang H, Quinn H, Pil sbury A, Hickie M, Deng L, et al. Surveil ance of adverse events
fol owing immunisation in Australia annual report, 2020. Communicable diseases intel igence (2018).
2022;46.
26.
Mahajan D, Roomiani I, Gold MS, Lawrence GL, McIntyre PB, Menzies RI. Annual report:
surveil ance of adverse events following immunisation in Australia, 2009. Commun Dis Intell.
2010;34(3):259-76.
27.
Dey A, Wang H, Quinn H, Hil R, Macartney K. Surveil ance of adverse events fol owing
immunisation in Australia annual report, 2014. Communicable Diseases Intelligence.
2016;40(3):E377–E90.
28.
Mahajan D, Dey A, Cook J, Harvey B, Menzies R, Macartney K. Surveil ance of adverse
events following immunisation in Australia annual report, 2012. Commun Dis Intell.
2014;38(3):E232– E46.
29.
Mahajan D, Dey A, Cook J, Harvey B, Menzies R, Macartney K. Surveil ance of adverse
events following immunisation in Australia annual report, 2013. Commun Dis Intell.
2015;39(3):E369–E86.
30.
Dey A, Wang H, Quinn H, Cook J, Macartney K. Surveil ance of adverse events fol owing
immunisation in Australia annual report, 2015. Communicable Diseases Intelligence.
2017;41(3):E264-E78.
31.
Dey A, Wang H, Quinn H, Cook J, Macartney K. Surveil ance of adverse events fol owing
immunisation in Australia annual report, 2016. Communicable Diseases Intelligence 2018;
42(PII:S2209-6051(18)00011-8) Epub 16/11/2018 2018 [Available from:
https://www1.health.gov.au/internet/main/publishing.nsf/Content/79C7257732247646CA2582A6000
D6345/$File/Surveil ance_of_adverse_events_fol owing_immunisation_in_Australia_annual_report,_
2016.pdf.
32.
Dey A, Wang H, Quinn H, Hiam R, Wood N, Beard F, et al. Surveil ance of adverse events
fol owing immunisation in Australia annual report, 2017. Communicable Diseases Intel igence 2019;
43. doi: 10.33321/cdi.2019.43.29.Epub 16/07/2019 2019 [Available from:
https://www1.health.gov.au/internet/main/publishing.nsf/Content/75F30C0D2C126CAECA25839400
15EDE3/$File/surveil ance_of_adverse_events_following_immunisation_in_australia_annual_report
_2017.pdf.
33.
Hul B, Hendry A, Dey A, Brotheron J, Macartney K, Beard F. Annual Immunisation Coverage
Report 2021. National Centre for Immunisation Research and Surveil ance; 2022.
34.
Hul BP, Hendry AJ, Dey A, Bryant K, Radkowski C, Pel issier S, et al. The impact of the
COVID-19 pandemic on routine vaccinations in Victoria. Med J Aust. 2021;215(2):83-4.
35.
Dey A, Wang H, Quinn H, Pil sbury A, Glover C, Hickie M, et al. Surveil ance of adverse
events following immunisation in Australia annual report, 2018. Communicable Diseases Intelligence
2020; 44 https://doi.org/10.33321/cdi.2020.44.12 Epub 16/3/2020 2020 [Available from:
https://www1.health.gov.au/internet/main/publishing.nsf/Content/AD2DF748753AFDE1CA2584E200
8009BA/$File/surveil ance_of_adverse_events_following_immunisation_in_australia_annual_report_
2018.pdf.
36.
Department of Health and Aged Care AG. Vaccine safety in Australia, AusVaxSafety
summary report 2021. 2022.
37.
Mahajan D, Cook J, Dey A, Macartney K, Menzies R. Supplementary report: surveil ance of
adverse events following immunisation among children aged less than seven years in Australia, 1
January to 30 June 2012. Commun Dis Intell. 2013;37(2):E130-4.
38.
Mahajan D, Cook J, McIntyre P, Macartney K, Menzies R. Supplementary report:
surveil ance of adverse events following immunisation among children aged less than seven years in
Australia, 1 January to 30 June 2011. Commun Dis Intel . 2012;36(1):114-9.
39.
Varricchio F, Iskander J, DeStefano F, Bal R, Pless R, Braun M, et al. Understanding
vaccine safety information from the Vaccine Adverse Event Reporting System. Pediatr Infect Dis J.
2004;23(4):287-94.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 14 of 28
Tables
Table 1. Vaccines listed as ‘suspected’ in reports of adverse events following immunisation (AEFI) in the
Adverse Event Management System database from NSW in 2021 (excluding COVID-19 vaccines), by age
group
Vaccine
Reporting rate per 100,000 doses
Age group Vaccine
AEFI reports
(n)a
Dosesb
(95% CI)
13vPCV
90
271,399
33.2 (26.7–40.8)
DTPa-HepB-IPV-Hib
77
274,372
28.1 (22.1–35.1)
Rotavirus
59
177,218
33.3 (25.3–42.9)
DTPa-IPV
58
93,349
62.1 (47.2–80.3)
MMR
43
90,849
47.3 (34.3–63.7)
MenB
41
81,935
50 (35.9–67.9)
<7 years
Influenza (seasonal - standard formulation)
37
147,579
25.1 (17.7–34.6)
MenACWY
35
91,202
38.4 (26.7–53.4)
DTPa
27
90,073
30 (19.8–43.6)
Hib
15
90,298
16.6 (9.3–27.4)
MMRV
14
90,157
15.5 (8.5–26.1)
Influenza (seasonal - high-dose or adjuvanted)
1
111
900.9 (22.8–4917.3)
HPV
20
142,450
14 (8.6–21.7)
dTpa
12
88,986
13.5 (7–23.6)
MenACWY
9
65,000
13.8 (6.3–26.3)
7-17 years Influenza (seasonal - standard formulation)
8
143,358
5.6 (2.4–11)
MenB
1
2,555
39.1 (1–217.9)
MMR
1
2,350
42.6 (1.1–236.9)
Influenza (seasonal - standard formulation)
122
1,332,342
9.2 (7.6–10.9)
dTpa
23
206,375
11.1 (7.1–16.7)
Hepatitis B
7
68,421
10.2 (4.1–21.1)
23vPPV
6
3,690
162.6 (59.7–353.6)
HPV
5
15,359
32.6 (10.6–76)
MMR
4
22,769
17.6 (4.8–45)
Influenza (seasonal - high-dose or adjuvanted)
3
12,500
24 (4.9–70.1)
18-64 years Zoster (RZV)
3
1,777
168.8 (34.8–492.6)
MenB
2
5,135
38.9 (4.7–140.6)
Zoster (ZVL)
2
2,669
74.9 (9.1–270.4)
Hepatitis A and hepatitis B
1
7,104
14.1 (0.4–78.4)
MMRV
1
591
169.2 (4.3–939.1)
13vPCV
1
8,630
11.6 (0.3–64.5)
Typhoid and hepatitis A
1
1,440
69.4 (1.8–386.3)
Influenza (seasonal - high-dose or adjuvanted)
55
893,038
6.2 (4.6–8)
13vPCV
24
98,299
24.4 (15.6–36.3)
Zoster (ZVL)
12
53,266
22.5 (11.6–39.3)
≥w65 years Influenza (seasonal - standard formulation)
8
74,662
10.7 (4.6–21.1)
dTpa
4
36,583
10.9 (3–28)
23vPPV
4
9,274
43.1 (11.8–110.4)
Zoster (RZV)
2
3,270
61.2 (7.4–220.8)
aNumber of AEFI reports in which the vaccine was coded as ‘suspected’ of causal involvement in the reported adverse event and the
vaccination was administered between 1 January and 31 December 2021. More than one vaccine may be coded as ‘suspected’ if
several were administered or reported at the same time
bNumber of vaccine doses recorded on the Australian Immunisation Register and administered between 1 January and 31 December
2021
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 15 of 28
Table 2. Vaccines listed as ‘suspected’ in reports of adverse events following immunisation in the Adverse
Event Management System database from NSW in 2021 (excluding COVID-19 vaccines)
One suspected vaccine
Serious AEFI
Aged <7 years Aged ≥7 years
Vaccinea
AEFI reports
n (%)b
only n (%)cf
n (%)df
n (%)ef
n (%)ef
Influenza (seasonal - standard
formulation)
183 (29.6)
163 (89.1)
24 (13.1)
37 (20.2)
138 (75.4)
13vPCV
119 (19.3)
20 (16.8)
23 (19.3)
90 (75.6)
25 (21)
DTPa-HepB-IPV-Hib
82 (13.3)
16 (19.5)
18 (22)
77 (93.9)
1 (1.2)
DTPa-IPV
61 (9.9)
54 (88.5)
2 (3.3)
58 (95.1)
2 (3.3)
Rotavirus
60 (9.7)
0 (0)
18 (30)
59 (98.3)
0 (0)
Influenza (seasonal - high-dose or
adjuvanted)
59 (9.5)
57 (96.6)
13 (22)
1 (1.7)
58 (98.3)
MMR
51 (8.3)
10 (19.6)
9 (17.6)
43 (84.3)
6 (11.8)
MenB
47 (7.6)
24 (51.1)
8 (17)
41 (87.2)
3 (6.4)
MenACWY
45 (7.3)
10 (22.2)
5 (11.1)
35 (77.8)
9 (20)
dTpa
39 (6.3)
25 (64.1)
3 (7.7)
0 (0)
39 (100)
DTPa
30 (4.9)
9 (30)
6 (20)
27 (90)
3 (10)
HPV
26 (4.2)
16 (61.5)
4 (15.4)
0 (0)
25 (96.2)
Hib
16 (2.6)
0 (0)
1 (6.2)
15 (93.8)
1 (6.2)
MMRV
15 (2.4)
2 (13.3)
2 (13.3)
14 (93.3)
1 (6.7)
Zoster (ZVL)
15 (2.4)
11 (73.3)
1 (6.7)
0 (0)
14 (93.3)
23vPPV
14 (2.3)
7 (50)
1 (7.1)
1 (7.1)
11 (78.6)
Varicella
10 (1.6)
5 (50)
3 (30)
3 (30)
7 (70)
DT
7 (1.1)
6 (85.7)
1 (14.3)
1 (14.3)
6 (85.7)
Hepatitis B
7 (1.1)
4 (57.1)
0 (0)
0 (0)
7 (100)
Zoster (RZV)
5 (0.8)
5 (100)
0 (0)
0 (0)
5 (100)
Meningococcal (unspecified)
3 (0.5)
1 (33.3)
3 (100)
2 (66.7)
1 (33.3)
7vPCV
3 (0.5)
0 (0)
1 (33.3)
3 (100)
0 (0)
Pneumococcal (unspecified)
3 (0.5)
0 (0)
2 (66.7)
3 (100)
0 (0)
DTP
2 (0.3)
0 (0)
1 (50)
2 (100)
0 (0)
DTPa-Hib
1 (0.2)
0 (0)
1 (100)
1 (100)
0 (0)
Hepatitis A and hepatitis B
1 (0.2)
0 (0)
0 (0)
0 (0)
1 (100)
Hib and MenCY
1 (0.2)
0 (0)
1 (100)
1 (100)
0 (0)
Hib and tetanus
1 (0.2)
0 (0)
0 (0)
1 (100)
0 (0)
Tick-borne encephalitis
1 (0.2)
1 (100)
0 (0)
0 (0)
1 (100)
Typhoid and hepatitis A
1 (0.2)
1 (100)
0 (0)
0 (0)
1 (100)
aSee appendix for abbreviations of vaccine names
bNumber of AEFI reports in which the vaccine was coded as ‘suspected’ of causal involvement in the reported adverse event and the
vaccination was administered between 1 January and 31 December 2021. More than one vaccine may be coded as ‘suspected’ if
several were administered or reported at the same time
cAEFI reports where only one vaccine was suspected of causal involvement in a reported adverse event
dAn adverse event report is defined as ‘serious’ if it meets one or more of the following criteria: (1) results in death; (2) is life-threatening;
(3) requires inpatient hospitalisation or prolongation of existing hospitalisation; (4) results in persistent or significant disability/incapacity;
(5) is a congenital anomaly/birth defect or; (6) is a medically important event or reaction
eIncludes only AEFI reports where an age or date of birth has been reported
fPercentages are calculated for the number of AEFI reports where the vaccine was suspected of causal involvement in the event
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 16 of 28
Table 3. The 50 most frequently reported adverse events classified by MedDRA Preferred Terms or
Standardised MedDRA queries in reports of adverse events following immunisation in the Adverse Event
Management System database from NSW in 2021 (excluding COVID-19 vaccines)
One PT only
Serious AEFI Aged <7 years Aged ≥7 years
PT or SMQ
AEFI reports
n (%)a
n (%)be
n (%)ce
n (%)de
n (%)de
Hypersensitivity
122 (19.7)
48 (39.3)
5 (4.1)
66 (54.1)
54 (44.3)
Injection site reaction
104 (16.8)
49 (47.1)
4 (3.8)
46 (44.2)
56 (53.8)
Pyrexia
104 (16.8)
5 (4.8)
11 (10.6)
62 (59.6)
39 (37.5)
Gastrointestinal nonspecific symptoms and
therapeutic procedures
77 (12.5)
8 (10.4)
12 (15.6)
36 (46.8)
39 (50.6)
Headache
46 (7.4)
0 (0)
6 (13)
2 (4.3)
44 (95.7)
Haemodynamic oedema, effusions and fluid
overload
44 (7.1)
15 (34.1)
4 (9.1)
27 (61.4)
17 (38.6)
Dyspnoea
28 (4.5)
1 (3.6)
6 (21.4)
6 (21.4)
21 (75)
Convulsions
25 (4)
13 (52)
18 (72)
21 (84)
2 (8)
Fatigue
25 (4)
1 (4)
2 (8)
0 (0)
24 (96)
Malaise
23 (3.7)
1 (4.3)
1 (4.3)
2 (8.7)
21 (91.3)
Lethargy
22 (3.6)
0 (0)
5 (22.7)
14 (63.6)
8 (36.4)
Angioedema
21 (3.4)
4 (19)
2 (9.5)
8 (38.1)
12 (57.1)
Arthralgia
20 (3.2)
2 (10)
1 (5)
0 (0)
20 (100)
Medication errors
19 (3.1)
10 (52.6)
0 (0)
4 (21.1)
13 (68.4)
Pain in extremity
19 (3.1)
2 (10.5)
0 (0)
1 (5.3)
17 (89.5)
Cough
18 (2.9)
0 (0)
3 (16.7)
6 (33.3)
12 (66.7)
Dizziness
17 (2.8)
0 (0)
1 (5.9)
0 (0)
17 (100)
Irritability
17 (2.8)
1 (5.9)
3 (17.6)
15 (88.2)
1 (5.9)
Myalgia
17 (2.8)
0 (0)
2 (11.8)
0 (0)
16 (94.1)
Paraesthesia
15 (2.4)
0 (0)
1 (6.7)
0 (0)
14 (93.3)
Tachycardia
15 (2.4)
0 (0)
3 (20)
5 (33.3)
10 (66.7)
Syncope
14 (2.3)
5 (35.7)
5 (35.7)
2 (14.3)
10 (71.4)
Anaphylactic/anaphylactoid shock conditions
13 (2.1)
8 (61.5)
5 (38.5)
5 (38.5)
8 (61.5)
Chills
13 (2.1)
0 (0)
1 (7.7)
1 (7.7)
12 (92.3)
Injection site pain
13 (2.1)
3 (23.1)
0 (0)
1 (7.7)
12 (92.3)
Rhinorrhoea
13 (2.1)
0 (0)
2 (15.4)
5 (38.5)
7 (53.8)
Chest pain
12 (1.9)
2 (16.7)
2 (16.7)
0 (0)
11 (91.7)
Pallor
12 (1.9)
0 (0)
2 (16.7)
7 (58.3)
4 (33.3)
Respiratory failure
12 (1.9)
2 (16.7)
2 (16.7)
12 (100)
0 (0)
Decreased appetite
10 (1.6)
0 (0)
1 (10)
8 (80)
2 (20)
Injection site cellulitis
10 (1.6)
5 (50)
0 (0)
6 (60)
4 (40)
Influenza like illness
9 (1.5)
1 (11.1)
0 (0)
0 (0)
9 (100)
Pruritus
9 (1.5)
0 (0)
0 (0)
3 (33.3)
6 (66.7)
Erythema
8 (1.3)
0 (0)
1 (12.5)
3 (37.5)
5 (62.5)
Hypotonia
8 (1.3)
1 (12.5)
2 (25)
8 (100)
0 (0)
Asthenia
7 (1.1)
0 (0)
0 (0)
0 (0)
7 (100)
Bradycardia
7 (1.1)
0 (0)
1 (14.3)
7 (100)
0 (0)
Concomitant disease aggravated
7 (1.1)
2 (28.6)
4 (57.1)
1 (14.3)
5 (71.4)
Hypotonic-hyporesponsive episode
7 (1.1)
4 (57.1)
3 (42.9)
6 (85.7)
1 (14.3)
Lymphadenopathy
7 (1.1)
1 (14.3)
1 (14.3)
0 (0)
7 (100)
Neonatal disorders
7 (1.1)
1 (14.3)
1 (14.3)
6 (85.7)
0 (0)
Confusional state
6 (1)
0 (0)
1 (16.7)
1 (16.7)
5 (83.3)
Herpes zoster
6 (1)
4 (66.7)
0 (0)
0 (0)
6 (100)
Migraine
6 (1)
1 (16.7)
0 (0)
0 (0)
6 (100)
Pain
6 (1)
1 (16.7)
0 (0)
0 (0)
6 (100)
Somnolence
6 (1)
0 (0)
2 (33.3)
5 (83.3)
1 (16.7)
Bell's palsy
5 (0.8)
4 (80)
3 (60)
1 (20)
3 (60)
Hypoaesthesia
5 (0.8)
2 (40)
0 (0)
0 (0)
5 (100)
Muscular weakness
5 (0.8)
1 (20)
1 (20)
1 (20)
3 (60)
Oxygen saturation decreased
5 (0.8)
0 (0)
1 (20)
5 (100)
0 (0)
Palpitations
5 (0.8)
0 (0)
0 (0)
0 (0)
5 (100)
Presyncope
5 (0.8)
2 (40)
0 (0)
0 (0)
5 (100)
Tremor
5 (0.8)
0 (0)
0 (0)
1 (20)
4 (80)
Wheezing
5 (0.8)
0 (0)
2 (40)
1 (20)
3 (60)
aNumber of AEFI reports in which the PT or SMQ was reported. More than one PT/SMQ may be recorded on the same report
bAEFI reports where only one PT or SMQ was reported
cAn adverse event report is defined as ‘serious’ if it meets one or more of the following criteria: (1) results in death; (2) is life-threatening;
(3) requires inpatient hospitalisation or prolongation of existing hospitalisation; (4) results in persistent or significant disability/incapacity;
(5) is a congenital anomaly/birth defect or; (6) is a medically important event or reaction
dIncludes only AEFI reports where an age or date of birth has been reported
ePercentages are calculated for the number of AEFI reports where the PT or SMQ was reported
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 17 of 28
 Figures
Figure 1
Figures
Figure 1. Adverse event fol owing immunisation reports in the Adverse Event Management System database from NSW, 2000 to 2021 (excluding COVID-19
vaccines), by year
For reports where the date of vaccination was not recorded, the date of symptom onset or the received date (when the event was reported to the sender of the case)
was used. For more details on changes to the National Immunisation Program, please refer to Table S1.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 19 of 28
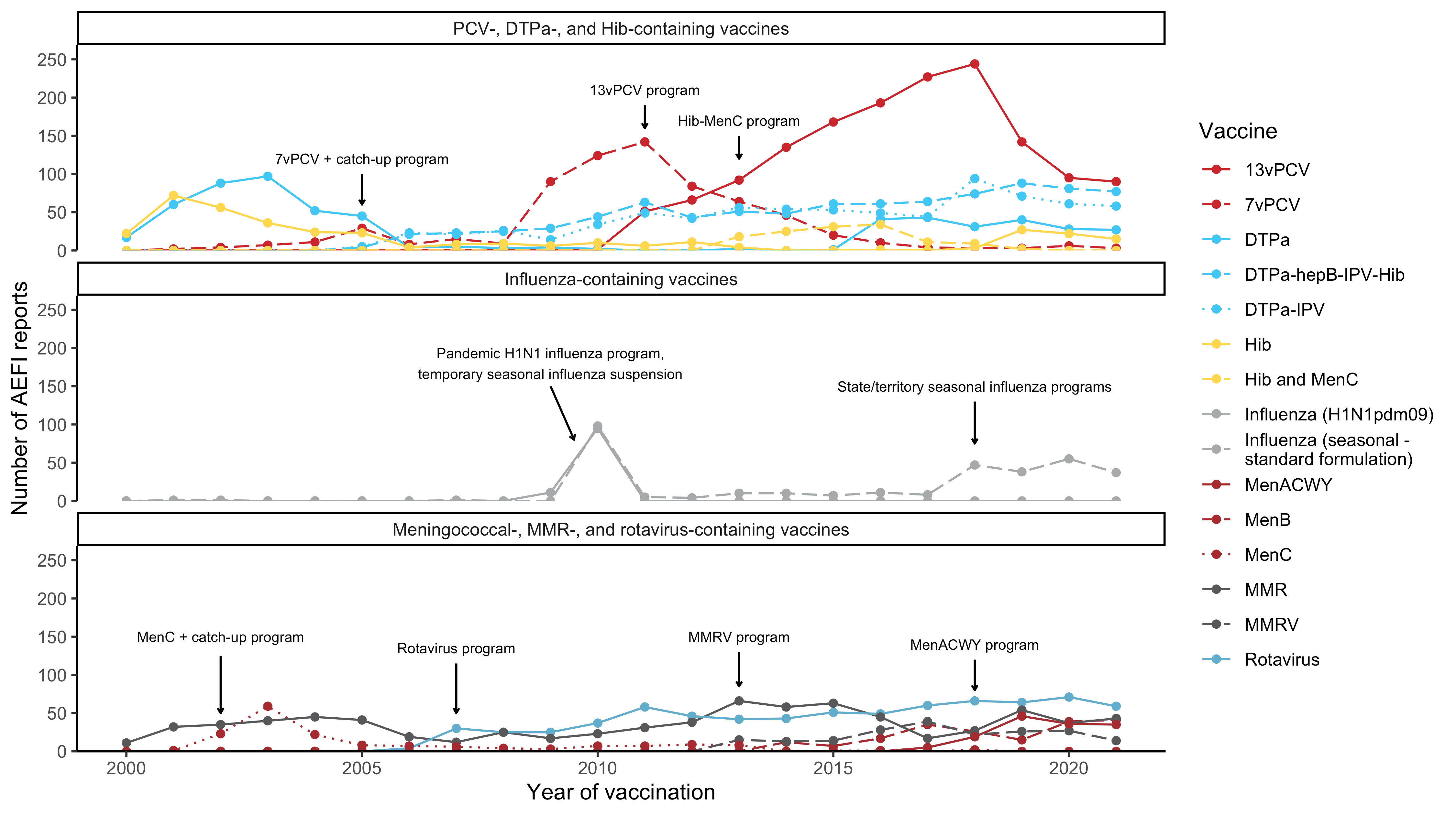 Figure 2
Figure 2. Adverse event fol owing immunisation reports in NSW for children aged <7 years in the Adverse Event Management System database from 2000 to 2021
(excluding COVID-19 vaccines), by year and vaccine
For reports where the date of vaccination was not recorded, the date of symptom onset or the received date (when the event was reported to the sender of the case)
was used. For more details on changes to the National Immunisation Program, please refer to Table S1.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 20 of 28
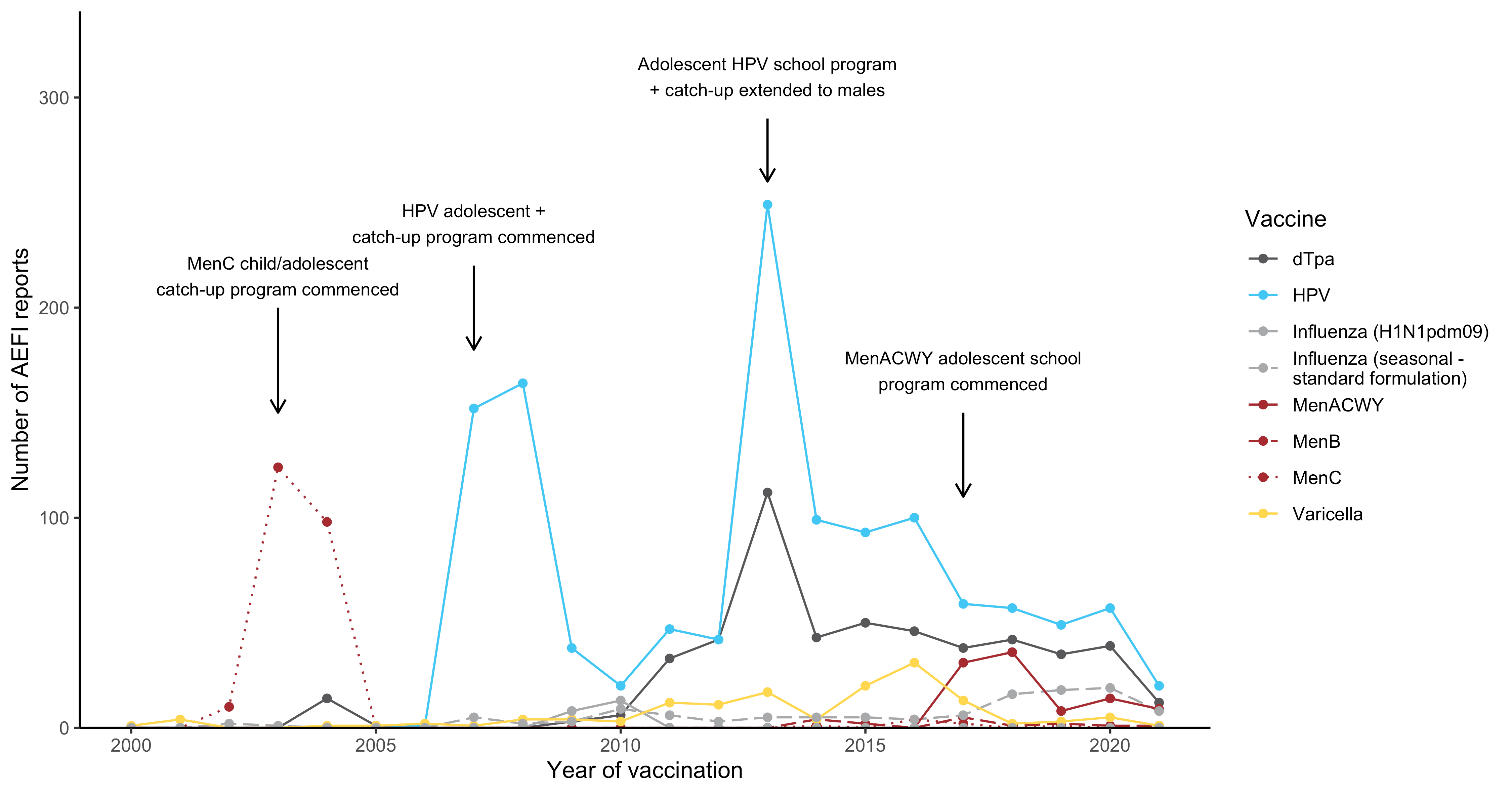 Figure 3
Figure 3. Adverse event fol owing immunisation reports in NSW for people aged 7 to 17 years in the Adverse Event Management System database from 2000 to
2021 (excluding COVID-19 vaccines), by year and vaccine
For reports where the date of vaccination was not recorded, the date of symptom onset or the received date (when the event was reported to the sender of the case)
was used. For more details on changes to the National Immunisation Program, please refer to Table S1.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 21 of 28
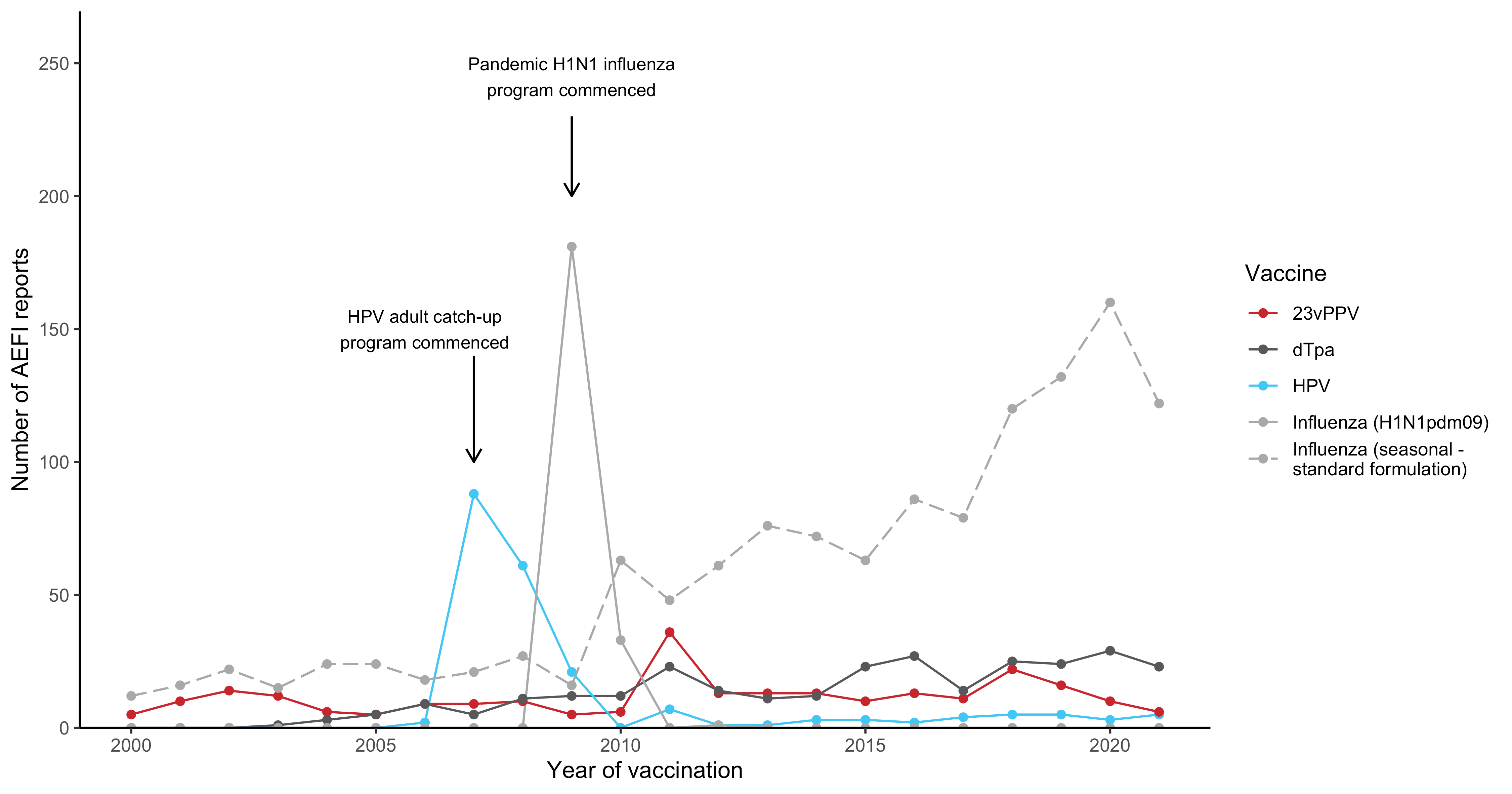 Figure 4
Figure 4. Adverse event fol owing immunisation reports in NSW for people aged 18 to 64 years in the Adverse Event Management System database from 2000 to
2021 (excluding COVID-19 vaccines), by year and vaccine
For reports where the date of vaccination was not recorded, the date of symptom onset or the received date (when the event was reported to the sender of the case)
was used. For more details on changes to the National Immunisation Program, please refer to Table S1.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 22 of 28
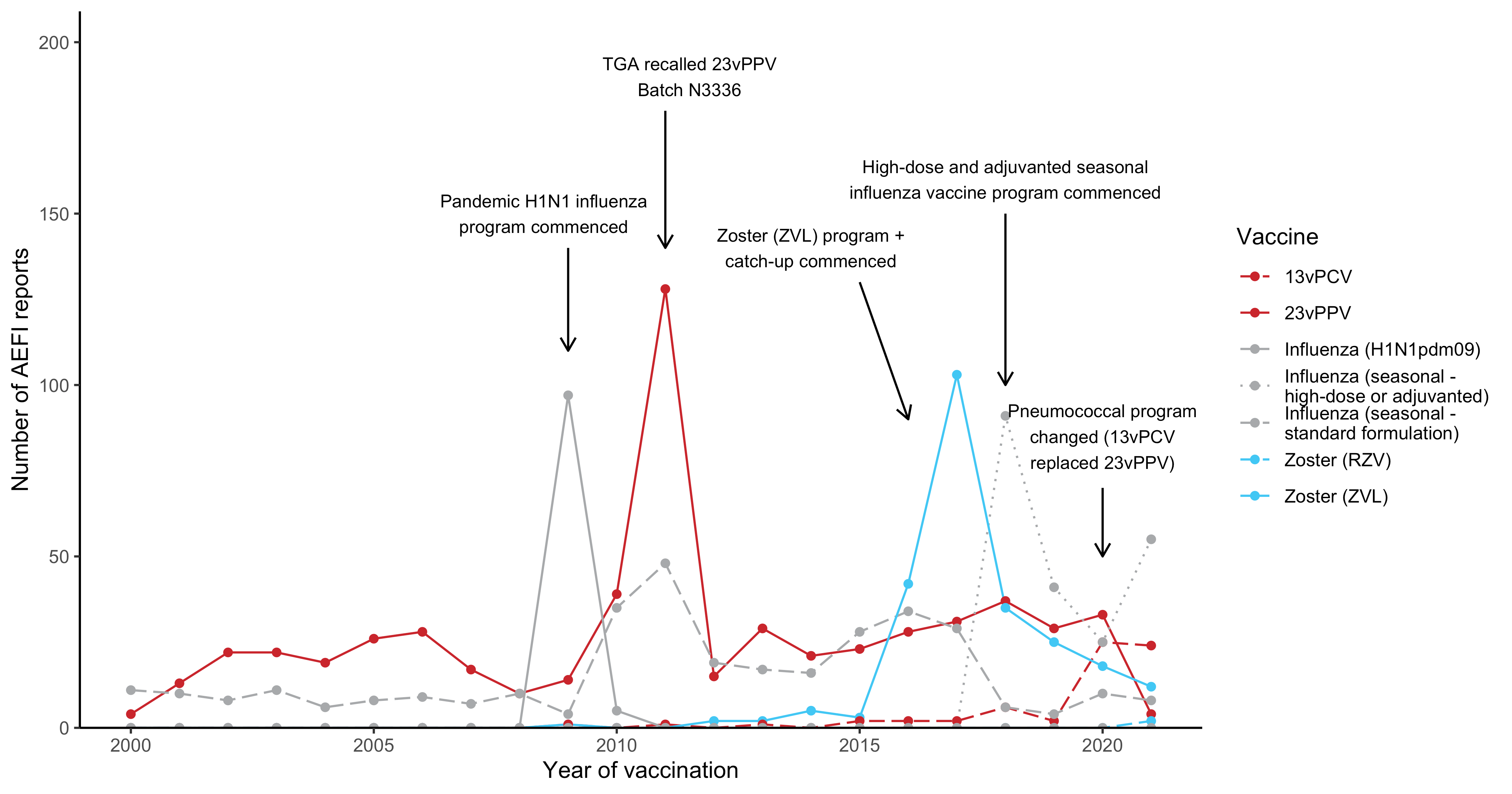 Figure 5
Figure 5. Adverse event fol owing immunisation reports in NSW for people aged ≥65 years in the Adverse Event Management System database from 2000 to 2021
(excluding COVID-19 vaccines), by year and vaccine
For reports where the date of vaccination was not recorded, the date of symptom onset or the received date (when the event was reported to the sender of the case)
was used. For more details on changes to the National Immunisation Program, please refer to Table S1.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 23 of 28
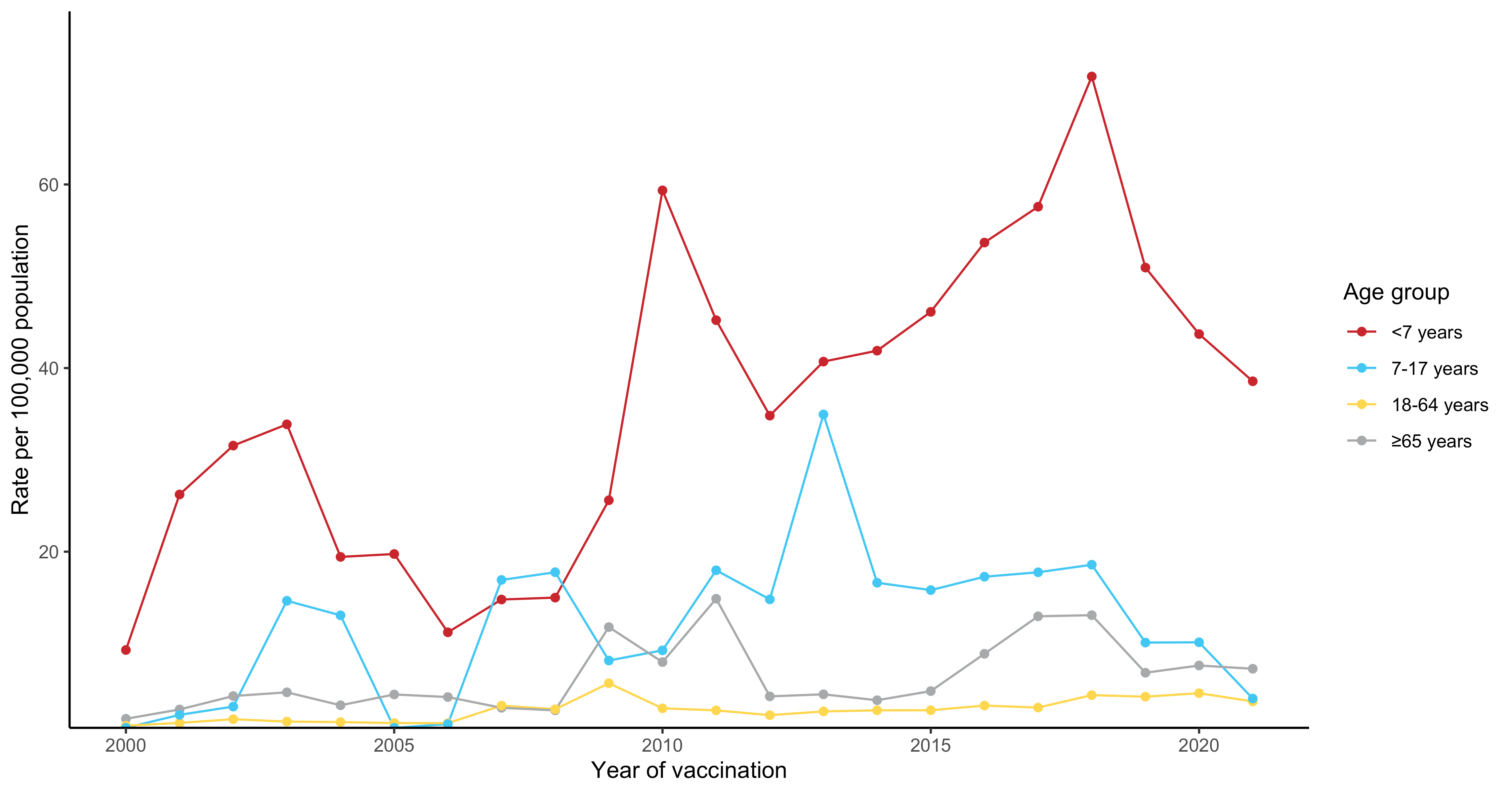 Figure 6
Figure 6. Reporting rates of adverse events fol owing immunisation in NSW per 100,000 population in the Adverse Event Management System database from 2000
to 2021 (excluding COVID-19 vaccines), by year and age group
For reports where the date of vaccination was not recorded, the date of symptom onset or the received date (when the event was reported to the sender of the case)
was used. For more details on changes to the National Immunisation Program, please refer to Table S1.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 24 of 28
Supplementary Material
Table S7. Changes in immunisation policy and the National Immunisation Program (NSW, 2005–2021)
Year
Change
2020
July 2020
A single dose of 13vPCV is recommended and funded for Aboriginal and Torres Strait
Islander adults at 50 years of age, followed by a dose of 23vPPV 12 months later and a 2nd
dose of 23vPPV 5–10 years after that.
A single dose of 13vPCV is recommended and funded for non- Aboriginal and Torres Strait
Islander adults at 70 years of age, replacing the previously funded dose of 23vPPV at 65
years of age.
Meningococcal B vaccine funded for al Aboriginal and Torres Strait Islander children (age <12
months) and individuals of any age with specified high risk medical conditions. Catch-up
available for all Aboriginal and Torres Strait Islander children <2 years of age (up to 23
months) for 3 years - until 30 June 2023.
March 2020
All children aged 6 months to <5 years funded for influenza vaccine under NIP.
First enhanced quadrivalent influenza vaccine (adjuvanted) funded nationally for adults aged
65 years and over.
2019
April 2019 Meningococcal ACWY conjugate vaccine funded under the NIP for adolescents aged 14–16
years delivered through a school-based program and adolescents aged 15 to 19 years
delivered through primary care providers as part of an ongoing catch-up program.
February 2019 Annual seasonal influenza vaccination funded on the national childhood vaccination schedule
for al Australian children aged 6 months – <5 years.
Aboriginal and Torres Strait Islander children and adolescents aged 5–14 years of age funded
for influenza vaccine under NIP.
2018
July 2018
Meningococcal ACWY conjugate vaccine funded for al children at 12 months of age,
replacing combined Hib and meningococcal C-containing vaccine.
Hib dose moved to 18 months and given as monovalent Hib vaccine.
Schedule for routine childhood vaccination with 13vPCV changed from 2, 4 and 6 months of
age to 2, 4 and 12 months of age.
April 2018
Enhanced trivalent influenza vaccines (high-dose and adjuvanted) funded nationally for all
adults aged ≥65 years.
Annual seasonal influenza vaccination funded by ACT, NSW, QLD, SA, TAS and VIC for al
children aged 6 months–<5 years
February 2018
A 2-dose schedule of 9vHPV funded for adolescents aged 12–14 years, delivered through a
school-based program; 4vHPV ceased to be used in the program.
January 2018
Meningococcal ACWY school-based vaccination program funded for all NSW secondary
school students in Years 10 and 11, as well as adolescents aged 15 to 19 years who have not
received the vaccine at school.
2016
November 2016
Zoster vaccine (Zostavax®) provided free for people aged 70 years under the National
Immunisation Program (NIP) with a five-year catch-up program for people aged 71 – 79 years.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 25 of 28
March 2016
Free booster dose of the diphtheria, tetanus, and acel ular pertussis-containing vaccine
(DTPa) at 18 months of age.
2015
April 2015
New immunisation requirements for family assistance payments were announced by the
federal government (the ‘No Jab, No Pay’ policy), to come into effect on 1 January 2016. Only
parents of children (aged less than 20 years) who are ‘fully immunised’ or on a recognised
catch-up schedule remain eligible to receive the Child Care Benefit, Child Care Rebate, and/or
the Family Tax Benefit Part A end-of-year supplement.
March 2015
Seasonal influenza vaccine funded for Aboriginal and Torres Strait Islander children aged 6
months to less than 5 years.
From March to June 2015, the dTpa vaccine for women during the third trimester of
pregnancy was funded by New South Wales, South Australia, Western Australia, the
Australian Capital Territory, Victoria and Tasmania. The Northern Territory had funded it since
September 2013 and Queensland since July 2014.
A booster dose of DTPa vaccine recommended at 18 months of age (funded in March 2016).
2014
December 2014
4vHPV vaccine catch-up program for males aged 14–15 years ceased
2013
December 2013
Secondary school Year 7 hepatitis B vaccine catch-up program ceased, as all younger age
cohorts were eligible for infant immunisation under the NIP (commenced 2000).
July 2013
Second dose of MMR vaccine, previously given at 4 years, was brought forward to 18 months
of age and delivered as MMRV vaccine.
Combined
Haemophilus influenzae type b (Hib) and meningococcal serogroup C (MenC)
vaccine, Menitorix®, was funded for infants aged 12 months. This combination vaccine
replaced the single dose of monovalent meningococcal C conjugate vaccine (MenCCV) and
booster dose of monovalent Hib vaccine previously scheduled at 12 months of age.
February 2013
4vHPV vaccine was extended to males aged 12–13 years, delivered through a school-based
program, with a catch-up program for males aged 14–15 years in 2013 and 2014.
2012
October 2012
A fourth dose of Prevenar 13®, (13vPCV, a 13-valent pneumococcal conjugate vaccine) was
listed on the National Immunisation Program (NIP) for Indigenous children, aged 12-18
months, residing in Queensland, South Australia, Western Australia and the Northern
Territory. This replaced the booster dose of Pneumovax23®, (23vPPV, a 23-valent
pneumococcal polysaccharide vaccine) administered between 18 and 24 months of age for
Indigenous children from these jurisdictions.
2011
1 October 2011 to 30 September 2012 All children aged between 12 – 35 months who had completed a primary pneumococcal
vaccination course with 7vPCV were eligible to receive a free supplementary dose of
Prevenar 13®
25 March 2011
TGA issued a recal of Batch N3336 of the 23 valent pneumococcal polysaccharide vaccine
23vPPV, Pneumovax® 23. April 2011: Health professionals were advised not to administer a
second or subsequent dose of Pneumovax 23 vaccine. December 2011: Revised
recommendations regarding which patients should be re-vaccinated under the NIP were
provided.
2010
Annual vaccination with seasonal trivalent influenza vaccine (TIV, containing 3 influenza
strains: A/H1N1, A/H3N2 and B) was funded under the NIP for people aged ≥6 months with
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 26 of 28
medical risk factors (previously subsidised through the Pharmaceutical Benefits Scheme) and
all Indigenous people aged ≥15 years (previously all Indigenous adults ≥50 years and 15–49
years with medical risk factors).
On 23 April 2010, the use of the 2010 seasonal TIV in children <5 years of age was
suspended by Australia’s Chief Medical Officer due to an increased number of reports of fever
and febrile convulsions post vaccination. A subsequent investigation identified that FluvaxÒ
and Fluvax juniorÒ (CSL Biotherapies), but neither of the other two available brands registered
for use in young children, were associated with an unacceptably high risk of febrile
convulsions. The recommendation to resume the use of seasonal influenza vaccine in children
aged 6 months to 5 years, using brands other than FluvaxÒ and Fluvax juniorÒ, was made in
August 2010.
2009
Late 2009
All states and territories were using the single hexavalent DTPa-IPV-Hib-HepB (Infanrix
hexaÒ) vaccine for al children at 2, 4 and 6 months of age, due to an international shortage of
Haemophilus influenzae type b (Hib) (PedvaxHibÒ [monovalent] and ComvaxÒ [Hib-HepB])
vaccines.
September 2009
Pandemic H1N1 2009 influenza vaccine (PanvaxÒ) was rol ed out across Australia from 30
September 2009 for people aged ≥10 years. From December 2009, the pandemic vaccine
was made available to children aged 6 months to 10 years.
2007
July 2007
Universal funded immunisation against rotavirus at 2 and 4 months of age (Rotarix®) or at 2, 4
and 6 months of age (Rotateq®).
April 2007
Funded immunisation against human papil omavirus for all Australian girls aged 12–13 years
delivered through a school-based program from April 2007, with a temporary catch-up
program through schools or primary care providers for females aged 13–26 years until
December 2009.
2005
November 2005
Universal funded immunisation against varicella at 18 months of age with a school-based
catch-up program for children at 10–13 years of age not previously vaccinated and without a
history of varicella infection (no funded catch-up for children 2–10 years of age).
IPV was funded to replace OPV, in combination vaccines.
January 2005
Universal funded infant 7-valent pneumococcal conjugate vaccine (7vPCV) program replaced
the previous targeted childhood program, with a catch-up program for children aged <2 years.
Universal 23-valent pneumococcal polysaccharide vaccine (23vPPV) for adults aged ≥65
years replaced previous subsidy through the Pharmaceutical Benefits Scheme.
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 27 of 28
Table S2. Description of PT to SMQ mapping
Number of SMQ mapped
Term reported
0
PT
1
SMQ
>1 (different levels)
SMQ of highest level (most descriptive)
SMQ preferred following clinician review and adjudication, or PT if preferred
>1 (same level)
SMQ could not be chosen
Surveil ance of adverse events fol owing immunisation, NSW, 2021
Page 28 of 28







