
Australian Public Assessment Report
for BNT162b2 (mRNA)
Proprietary Product Name: Comirnaty
Sponsor: Pfizer Australia Pty Ltd
January 2021
Therapeutic Goods Administration
About the Therapeutic Goods Administration (TGA)
•
The Therapeutic Goods Administration (TGA) is part of the Australian Government
Department of Health and is responsible for regulating medicines and medical devices.
•
The TGA administers the
Therapeutic Goods Act 1989 (the Act), applying a risk
management approach designed to ensure therapeutic goods supplied in Australia
meet acceptable standards of quality, safety and efficacy (performance) when
necessary.
•
The work of the TGA is based on applying scientific and clinical expertise to decision-
making, to ensure that the benefits to consumers outweigh any risks associated with
the use of medicines and medical devices.
•
The TGA relies on the public, healthcare professionals and industry to report problems
with medicines or medical devices. TGA investigates reports received by it to
determine any necessary regulatory action.
•
To report a problem with a medicine or medical device, please see the information on
the TGA websit
e <https://www.tga.gov.au>.
About AusPARs
•
An Australian Public Assessment Report (AusPAR) provides information about the
evaluation of a prescription medicine and the considerations that led the TGA to
approve or not approve a prescription medicine submission.
•
AusPARs are prepared and published by the TGA.
•
An AusPAR is prepared for submissions that relate to new chemical entities, generic
medicines, major variations and extensions of indications.
•
An AusPAR is a static document; it provides information that relates to a submission at
a particular point in time.
•
A new AusPAR will be developed to reflect changes to indications and/or major
variations to a prescription medicine subject to evaluation by the TGA.
Copyright
© Commonwealth of Australia 2021
This work is copyright. You may reproduce the whole or part of this work in unaltered form for your own personal
use or, if you are part of an organisation, for internal use within your organisation, but only if you or your
organisation do not use the reproduction for any commercial purpose and retain this copyright notice and all
disclaimer notices as part of that reproduction. Apart from rights to use as permitted by the
Copyright Act 1968 or
allowed by this copyright notice, all other rights are reserved and you are not allowed to reproduce the whole or any
part of this work in any way (electronic or otherwise) without first being given specific written permission from the
Commonwealth to do so. Requests and inquiries concerning reproduction and rights are to be sent to the TGA
Copyright Officer, Therapeutic Goods Administration, PO Box 100, Woden ACT 2606 or emailed to
<xxx.xxxxxxxxx@xxx.xxx.xx>.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 2 of 42
FINAL 25 January 2021
link to page 4 link to page 7 link to page 7 link to page 8 link to page 9 link to page 11 link to page 11 link to page 12 link to page 12 link to page 14 link to page 15 link to page 31 link to page 33 link to page 39 link to page 41
Therapeutic Goods Administration
Contents
List of abbreviations
4
I. Introduction to product submission
7
Submission details ___________________________________________________________ 7
Product background ________________________________________________________ 8
Regulatory status ____________________________________________________________ 9
Product Information ______________________________________________________ 11
II. Registration timeline
11
III. Submission overview and risk/benefit assessment 12
Quality _______________________________________________________________________ 12
Nonclinical __________________________________________________________________ 14
Clinical_______________________________________________________________________ 15
Risk management plan ____________________________________________________ 31
Risk-benefit analysis ______________________________________________________ 33
Outcome _____________________________________________________________________ 39
Attachment 1. Product Information
41
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 3 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
List of abbreviations
Abbreviation
Meaning
ACV
Advisory Committee on Vaccines
AE
Adverse event
AESI
Adverse event of special interest
ARGPM
Australian Regulatory Guidelines for Prescription Medicines
ARTG
Australian Register of Therapeutic Goods
ASA
Australian specific annex
AusPAR
Australian Public Assessment Report
CD
Cluster of differentiation
CDC
Centers for Disease Control and Prevention
CHMP
Committee for Medicinal Products for Human Use (European
Medicines Agency)
CMI
Consumer Medicines Information
COPD
Chronic obstructive pulmonary disease
COVID-19
Coronavirus disease 2019
CPD
Certified Product Details
DLP
Data lock point
DP
Drug product
DS
Drug substance
ELISpot
Enzyme-linked immune absorbent spot
EMA
European Medicines Agency (European Union)
EU
European Union
EUA
Emergency Use Authorization (United States)
FDA
Food and Drug Administration (United States)
FIH
First in human
GCP
Good Clinical Practice
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 4 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
Abbreviation
Meaning
GMFR
Geometric mean fold rise
GMT
Geometric mean titre
GMP
Good Manufacturing Practice
GVP
Good Pharmacovigilance Practice(s)
HIV
Human immunodeficiency virus
ICS
Intracel ular cytokine staining
IFNγ
Interferon gamma
IgG
Immunoglobulin G
IL-2
Interleukin 2
IL-4
Interleukin 4
IM
Intramuscular
LNP
Lipid nanoparticle
MedDRA
Medical Dictionary for Regulatory Activities
modRNA
Modified messenger ribonucleic acid
mRNA
Messenger ribonucleic acid
NAAT
Nucleic acid amplification test
N-binding
Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2)
nucleoprotein-binding
OCABR
Official Control Authority Batch Release
PBRER
Periodic benefit risk evaluation report
PCR
Polymerase chain reaction
PI
Product Information
Pr
Posterior probability
PSUR
Periodic safety update report
QC
Quality control
RBD
Receptor-binding domain
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 5 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
Abbreviation
Meaning
RMP
Risk management plan
RT-PCR
Reverse transcription-polymerase chain reaction
S
Spike glycoprotein of severe acute respiratory syndrome
coronavirus 2/SARS-CoV-2
SAE
Serious adverse event
SARS-CoV-2
Severe acute respiratory syndrome coronavirus 2
SIRVA
Shoulder injury related to vaccine administration
SOC
System Organ Class
TGA
Therapeutic Goods Administration
Th1
T helper cell type 1
Th2
T helper cell type 2
UK
United Kingdom
US
United States
VAED
Vaccine-associated enhanced disease
VAERD
Vaccine-associated enhanced respiratory disease
VE
Vaccine efficacy
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 6 of 42
FINAL 25 January 2021
link to page 7 link to page 7
Therapeutic Goods Administration
I. Introduction to product submission
Submission details
Type of submission:
New biological entity
Product name:
Comirnaty
Active ingredient:
BNT162b2 (mRNA)
1
Decision:
Approved for provisional registration
Date of decision:
24 January 2021
Date of entry onto ARTG:
25 January 2021
ARTG number:
346290
Black Triangle Scheme:2 Yes
As a provisionally registered product, this medicine will remain
in the Black Triangle Scheme for the duration of its provisional
registration
Sponsor’s name and address: Pfizer Australia Pty Ltd
Level 17, 151 Clarence Street
Sydney NSW 2000
Dose form:
Concentrated suspension for injection
Strength:
30 µg/0.3 mL
Container:
Multi dose vial
Pack size:
195
Approved therapeutic use:
Comirnaty (BNT162b2 (mRNA)) COVID-19 vaccine has provisional
approval for the indication below:
Active immunisation to prevent coronavirus disease 2019
(COVID-19) caused by SARS-CoV-2, in individuals 16 years
of age and older.
The use of this vaccine should be in accordance with
official recommendations.
The decision has been made on the basis of short term efficacy and
safety data. Continued approval depends on the evidence of longer
1 Pending decision on the International Nonproprietary Name (INN) and the Australian Approved Name
(AAN).
2 The
Black Triangle Scheme provides a simple means for practitioners and patients to identify certain types
of new prescription medicines, including those being used in new ways and to encourage the reporting of
adverse events associated with their use. The Black Triangle does not denote that there are known safety
problems, just that the TGA is encouraging adverse event reporting to help us build up the full picture of a
medicine's safety profile.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 7 of 42
FINAL 25 January 2021
link to page 8 link to page 8 link to page 8 link to page 8
Therapeutic Goods Administration
term efficacy and safety from ongoing clinical trials and post-
market assessment.
Route of administration:
Intramuscular
Dosage:
Individuals 16 years of age and older
Comirnaty is administered intramuscularly after dilution as a
course of 2 doses at least 21 days apart.
For further information regarding dosage, refer to the
Product Information.
Pregnancy category:
B1
Drugs which have been taken by only a limited number of
pregnant women and women of childbearing age, without an
increase in the frequency of malformation or other direct or
indirect harmful effects on the human fetus having been
observed.
Studies in animals have not shown evidence of an increased
occurrence of fetal damage.
The use of any medicine during pregnancy requires careful
consideration of both risks and benefits by the treating health
professional. This must not be used as the sole basis of decision
making in the use of medicines during pregnancy. The TGA does
not provide advice on the use of medicines in pregnancy for
specific cases. More information is available from obstetric drug
information services in your State or Territory.
Product background
This AusPAR describes the application by Pfizer Australia Pty Ltd (the sponsor) to register
Comirnaty (BNT162b2 messenger ribonucleic acid (mRNA)) 30 µg/0.3 mL concentrated
suspension for injection for the following proposed indication:
Active immunisation against COVID-19 disease caused by SARS-CoV-2 virus in
individuals aged 16 years and over.
Coronavirus disease 2019 (COVID-19) is an infectious disease caused by the novel
coronavirus, severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2), that was
first identified in late 2019.
3 It is predominantly a respiratory illness that can affect other
organs.
4 People infected with COVID-19 can present with a wide range of symptoms, from
mild symptoms to severe illness.
5 Following exposure to the virus, symptoms may appear
within 2 to 14 days, and may include any or a combination of the following: fever or chil s,
cough, fatigue, shortness of breath, headache, muscle or body aches, sore throat, new loss
of taste or smell, congestion or runny nose, nausea or vomiting, and diarrhoea
.5 Infections
caused by SARS-CoV-2, and the resulting disease, COVID-19, have spread globally.
3 Zhu, N. et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019.
The New England journal of
medicine. 2020; 382(8): 727-733.
4 McIntosh, K. Coronavirus disease 2019 (COVID-19): Clinical features, In:
UpToDate, Waltham, MA (Accessed
on 12 January 2021). Available from the
UpToDate website.
5 National Center for Immunization and Respiratory Diseases (NCIRD), Division of Viral Diseases, Centers for
Disease Control and Prevention (CDC; 2020). Symptoms of Coronavirus. Last updated 22 December 2020.
Available from the CDC website.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 8 of 42
FINAL 25 January 2021
link to page 9 link to page 9 link to page 9 link to page 9 link to page 9
Therapeutic Goods Administration
On 11 March 2020, the World Health Organization (WHO) declared the COVID-19
outbreak to be a pandemic.
6 As of 24 January 2021, there have been more than 96 million
confirmed cases of COVID-19, and over 2 million deaths globally since the pandemic
began.
7 Immunisation with a safe and effective COVID-19 vaccine is a critical component of the
public health strategy to reduce COVID-19-related illnesses, hospitalisations, and deaths,
and to help restore societal functioning. At the time this submission was under
consideration, there were no vaccines approved in Australia to prevent SARS-CoV-2
infections or COVID-19. There remains an urgent and unmet medical and public health
need for a preventive vaccine.
The Pfizer-BioNTech COVID-19 vaccine, BNT162b2 mRNA (tradename Comirnaty),
comprises a nucleoside-modified messenger RNA (modRNA) encoding the viral spike
glycoprotein (S) of SARS-CoV-2.
8 The RNA is encapsulated in lipid nanoparticles (LNPs),
which enables entry into host cells, expression of the S protein, and elicitation of both
antibody and cellular immune responses. The vaccine is supplied as a white to off white
sterile frozen liquid, packaged in a multi dose clear glass 2 mL vial with a rubber stopper,
stored in -60 to -90°C. The vials are packed in cartons containing 195 multi dose vials, and
are intended for use over a short time window (calculated from its first use) due to its
preservative free composition.
The evaluation of the Comirnaty vaccine was significantly expedited without
compromising the TGA’s strict standards of safety, quality and efficacy. This was facilitated
through rolling data submission,
9 and through collaboration with international regulators.
The provisional determination for the Pfizer-BioNTech COVID-19 vaccine, BNT162b2
(mRNA) was granted by TGA on 14 October 2020. The provisional approval pathway
allows sponsors to apply for provisional registration on the ARTG.
10
Regulatory status
This product is considered a new biological entity for Australian regulatory purposes.
At the time the TGA considered this application, a similar application was under
consideration in the European Union (EU), Canada, Switzerland and New Zealand (all
submitted in October 2020). Applications for temporary authorisation and Emergency Use
6 World Health Organization (20
20) WHO Director-General speeches: WHO Director-General's opening
remarks at the media briefing on COVID-19 - 11 March 2020. Available from the WHO website.
7 World Health Organization, Coronavirus disease (COVID-19) dashboard. Accessed 24 January 2021. Available
from the WHO website a
t https://covid19.who.int/ .
8 Further information regarding mRNA technology in vaccines can be found at
https://www.phgfoundation.org/documents/rna-vaccines-an-introduction-briefing-note.pdf
9 Under normal circumstances, TGA's assessment (for both provisional and general registration) begins once
all information to support registration is available. As part of the Department of Health's response to the
pandemic, the TGA has agreed to accept
rolling data for COVID-19 vaccines, to enable early evaluation of data
as it comes to hand.
10 As part of the
provisional approval pathway, the provisional registration process wil al ow certain
medicines to be provisional y registered in the Australian Register of Therapeutic Goods (ARTG) for a limited
duration. These medicines are registered on the basis of preliminary clinical data, where there is the potential
for a substantial benefit to Australian patients. The TGA wil re-assess risks related to the absence of evidence
through data provided at a later stage, as part of the confirmatory data. Confirmatory data should confirm the
relationship between outcomes predicted by the surrogate endpoint, or other preliminary data, and the
clinical benefit as demonstrated by direct clinical outcomes.
The sponsor may apply to transition to full registration at any time up until the provisional registration lapse
date, once they have completed the obligations outlined for the provisional registration period and complete
confirmatory data on safety and efficacy are available.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 9 of 42
FINAL 25 January 2021
link to page 10
Therapeutic Goods Administration
Authorization (EUA) were also submitted in the United Kingdom (UK) and United States
(US), respectively.
As of 13 January 2021, the following approvals and authorisations for the Pfizer-BioNTech
COVID-19 vaccine, BNT162b2 (mRNA) had been issued in international jurisdictions (see
Table 1).
Table 1: International regulatory status
Region
Submission date
Status
Approved indications
European
5 October 2020
Approved
Comirnaty is indicated for
Union
(first roll
(conditional
active immunisation to prevent
(Centralised submitted)
authorisation
COVID-19 caused by SARS-CoV-
Procedure)
granted)
2 virus, in individuals 16 years
21 December 2020
of age and older.
UK
1 October 2020
Approved
Active immunisation to
(temporary
prevent COVID-19 caused by
authorisation)
SARS-CoV-2 virus, in
2 December 2020
individuals 16 years of age
and older. The use of COVID-
19 mRNA Vaccine BNT162b2
should be in accordance with
official guidance.
USA
20 November 2020 Approved
Pfizer-BioNTech COVID-19
(application for
(authorised for
Vaccine is authorized for use
EUA submitted)
emergency use)
under an Emergency Use
11 December 2020
Authorization (EUA) for active
immunization to prevent
coronavirus disease 2019
(COVID-19) caused by severe
acute respiratory syndrome
coronavirus 2 (SARS-CoV-2) in
individuals 16 years of age and
older.
Canada
9 October 2020
Approved
Pfizer-BioNTech COVID-19
(interim order)
Vaccine (COVID-19 mRNA
9 December 2020
Vaccine) is indicated for active
immunization to prevent
coronavirus disease 2019
(COVID-19) caused by severe
acute respiratory syndrome
coronavirus 2 (SARS-CoV-2) in
individuals 16 years of age and
older.
Switzerland 16 October 2020
Approved
Comirnaty is indicated for
(conditional
active immunisation to prevent
approval)
COVID-19 caused by
19 December 2020
SARS-CoV-2 virus, in individuals
16 years of age and older.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 10 of 42
FINAL 25 January 2021
link to page 9 link to page 11
Therapeutic Goods Administration
Region
Submission date
Status
Approved indications
Singapore
3 December 2020
Approved
Active immunization to prevent
(Pandemic Special
coronavirus disease 2019
Access Route)
(COVID-19) caused by severe
14 December 2020
acute respiratory syndrome
coronavirus 2 (SARS-CoV-2) in
individuals 16 years of age and
older.
New
21 October 2020
Under
Under consideration
Zealand
consideration
UK = United Kingdom; USA = United States of America; EUA = Emergency Use Authorization
Product Information
The Product Information (PI) approved with the submission which is described in this
AusPAR can be found as Attachment 1. For the most recent PI, please refer to the TGA
website at
<https://www.tga.gov.au/product-information-pi>.
II. Registration timeline
The following table captures the key steps and dates for this application and which are
detailed and discussed in this AusPAR.
Data were provided as a rolling submission
.9
Table 2: Timeline for Submission PM-2020-05461-1-2
Description
Date
Designation (Provisional)
14 October 2020
Submission dossier accepted and first round evaluation 2 November 2020
11
commenced
Evaluation completed
8 January 2021
Delegate’s Overall benefit-risk assessment and request
11 January 2021
for Advisory Committee advice
Sponsor’s pre-Advisory Committee response
13 January 2021
Advisory Committee meeting
15 January 2021
Registration decision (Outcome)
24 January 2021
Completion of administrative activities and registration 25 January 2021
on the ARTG
11 Submission of rolling data for this application commenced on 23 October 2020.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 11 of 42
FINAL 25 January 2021
link to page 12 link to page 12 link to page 12 link to page 12
Therapeutic Goods Administration
Description
Date
Number of working days from submission dossier
54
acceptance to registration decision*
*Statutory timeframe for standard applications is 255 working days
III. Submission overview and risk/benefit assessment
The submission was summarised in the following Delegate’s overview and
recommendations.
The Delegate referenced the following guidelines:
•
European Medicines Agency (EMA) Guideline on Clinical Evaluation of New Vaccines.
12
•
Access Consortium statement on COVID-19 vaccines evidence.
13 14
Quality
The quality evaluator states that there are no significant issues identified from the quality
evaluation of the submitted data that would indicate the product should not be
provisionally registered on the basis of quality, or safety-related issues arising from the
quality of the product. The manufacturing quality information submitted by the sponsor
support the provisional registration of COVID-19 vaccine BNT162b2 (mRNA)
30 µg/0.3 mL concentrated suspension for injection vial. However, it should be noted that
there are some issues that need to be fully resolved before it is possible to provide
assurances that the product is able to meet all of the requirements of the Therapeutics
Goods Act 1989 and its associated instruments. There are specific conditions and
obligations to be fulfilled post approval. The proposed quality conditions are shown below
in ‘
Proposed quality conditions of registration’. In terms of prior to product release to
market, the batch release testing and compliance is required to be fulfilled, as well as the
sponsor’s commitment not to supply any batches that have a temperature deviation
during shipment. All other quality conditions are post-market conditions.
The sponsor has submitted a Section 14 exemption application for the use of the
international lab
el.15 This is considered acceptable due to the public health emergency.
The multi-dose vial presentation is also considered acceptable in the pandemic situation.
12 EMA, Committee for Medicinal Products for Human Use (CHMP), Guideline on Clinical Evaluation of New
Vaccines EMEA/CHMP/VMP/164653/2005, October 2006. Available from the EMA website.
13 Access Consortium statement on COVID-19 vaccines evidence (published on 4 December). Available from
the TGA website at https://www.tga.gov.au/access-consortium-statement-covid-19-vaccines-evidence.
14 The
Access Consortium is a medium-sized coalition, which was formed in 2007 by 'like-minded' regulatory
authorities to promote greater regulatory col aboration and alignment of regulatory requirements. The
consortium currently comprises the national regulatory authorities of Australia, Canada, Singapore,
Switzerland and the UK. For further information visit: https://www.tga.gov.au/australia-canada-singapore-
switzerland-united-kingdom-access-consortium.
15 Medicines and other therapeutic goods must comply with applicable standards to be supplied in Australia.
Therapeutic Goods Order 91 (TGO91) sets out the standards required for labels of prescription and related
medicines. Under the Therapeutic Goods Act 1989 prior consent must be given under
Sections 14 and 14A of
the Act to the import, export or supply of therapeutic goods that do not comply with an applicable standard.
The Secretary can impose conditions on the consent under Section 15 of the Act.
Section 14 consent decisions are listed on the TGA website at https://www.tga.gov.au/ws-s14-index.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 12 of 42
FINAL 25 January 2021
link to page 13
Therapeutic Goods Administration
Proposed quality conditions of registration
The sponsor has submitted the list of manufacturing sites along with the responsibilities in
the production of the BNT162b2 drug substance (DS) and drug product (DP) and specified
functions. Commitment is required from the sponsor that they maintain the validity of all
manufacturer Good Manufacturing Practice (GMP) clearances for the duration of product
supply to Australia.
16 Additionally, that adherence to the conditions of GMP clearance
approval is upheld.
Prior to the vaccine release to the market, the batch release testing and compliance is
required to be fulfilled, as well as the sponsor’s commitment not to supply any batches
that have a temperature deviation during shipment.
•
Batch release testing and compliance It is a condition of registration that all independent manufacturing batches of
Comirnaty (BNT162b2 (mRNA)) COVID-19 vaccine to be supplied in Australia are not
released for supply by or on behalf of the sponsor until samples and the
manufacturer’s release data have been assessed by, and the sponsor has received
notification acknowledging authorisation to release from, the Laboratories Branch,
TGA.
In complying with the above, the sponsor must supply the following for each
independent batch of the product imported or proposed to be imported into Australia:
– A completed Request for Release Form, available from
xxxxxxxx@xxxxxx.xxx.xx ;
and
– complete summary protocols for manufacture and QC, including all steps in
production in the agreed format; and
– at least 20 (twenty) vials (samples) of each manufacturing batch of
BNT162b2(mRNA) COVID-19 vaccine with the Australian labels, PI and packaging
(unless an exemption to supply these has been granted) representative of all
batches of product proposed to be distributed in Australia; and
– if the manufacturing batch has been released in Europe or United Kingdom (UK) a
copy of the EU Official Control Authority Batch Release (OCABR) certificate (or
equivalent from the UK) must also be provided; and
– any reagents, reference material and standards required to undertake testing as
requested by Laboratories Branch, TGA.
•
Certified Product Details
An electronic copy of the Certified Product Details (CPD) as described in Guidance 7:
Certified Product Details of the Australian Regulatory Guidelines for Prescription
Medicines (ARGP
M) https://www.tga.gov.au/guidance-7-certified-product-details should
be provided upon registration of the therapeutic good. In addition, an updated CPD, for the
above products incorporating the approved changes is to be provided within one month of
the date of approval letter. A template for preparation of CPD for biological prescription
medicines and Vaccines can be obtained from the TGA website
https://www.tga.gov.au/form/certified-product-details-cpd-biological-prescription-
medicines]. The CPD should be sent as a single bookmarked PDF document t
o
xxxxxxxx@xxxxxx.xxx.xx as soon as possible after registration/approval of the product or
any subsequent changes as indicated above.
16
Good Manufacturing Practice (
GMP) is the minimum standard that a medicines manufacturer must meet
in their production processes. Products must be of consistent high quality; be appropriate to their intended
use; and meet the requirements of the marketing authorisation or product specification.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 13 of 42
FINAL 25 January 2021
link to page 14 link to page 14
Therapeutic Goods Administration
•
Post approval commitments
As this medicine is being considered for provisional registration, extensive
post-approval commitments will be required of the sponsor. The additional requested
quality data and notifications to the TGA should be provided as post-approval
commitments. This includes the following commitments:
– Additional data should be provided in relation to the reference standards and
materials.
– Additional stability data should be submitted as it becomes available. Once
additional data have been submitted to the TGA for evaluation, an extended shelf
life and/or change in storage conditions for the DS and/or DP may be considered.
– A commitment is required not to supply any batches that have a temperature
deviation during shipment.
– Additional information should be provided regarding batch analyses.
– Additional data should be provided in relation to process validation of commercial
scale batches.
– Additional data should be provided for the proposed rapid sterility test.
– The requested leachables study data should be provided.
17
Nonclinical
There are no nonclinical objections to the provisional registration of the vaccine. The
summary and conclusions are presented below.
•
Primary pharmacology studies indicate the vaccine elicits both neutralising antibody
and cellular immune responses to the spike (S) antigen in mice and monkeys, and
conferred some protection of monkeys from infection.
•
Antibodies and T cells in monkeys declined quickly over 5 weeks after the second dose
of BNT162b2 (V9),
18 raising concerns over long term immunity, which will be assessed
by clinical studies according to the sponsor.
•
Repeat dose toxicity studies with the proposed vaccine and a variant, both in the LNP
formulation, in rats raised no safety issues. Findings were consistent with immune
stimulation and inflammation responses (injection site inflammation, increased body
temperature, leucocytosis, increased large unstained cells, fibrinogen and acute phase
proteins, and hypercellularity of lymphohaematopoietic tissues). Hepatocyte
vacuolation (probably lipid vacuoles) was not associated with evidence of liver injury
and was reversible.
•
The toxicity of the LNP formulation and novel excipients ALC-0159 and ALC-0315 was
assessed in one species as part of the repeat dose study with the vaccine. Neither the
mRNA nor the lipid excipients of the LNP formulation are expected to have genotoxic
potential. However, the potential of the LNP or the vaccine formulation for
complement activation or stimulation of cytokine release was not adequately assessed
in nonclinical studies. Further investigation (that is, analysis of complement activation
and cytokine stimulation) is recommended unless this particular concern is addressed
17 A
leachables study examines the migration of mobile chemicals from components using in the manufacture
and storage of a pharmaceutical product.
18
BNT162b2 (V9) is the sponsor’s final commercial candidate of the mRNAs encoding the S protein including
BNT162b2, formulated in LNP; tradename Comirnaty.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 14 of 42
FINAL 25 January 2021
link to page 15
Therapeutic Goods Administration
by clinical data. The absence of a repeat dose toxicity study in a second species and
genotoxicity studies with the novel excipients was adequately justified by the sponsor.
•
A combined reproductive and developmental study showed no adverse effects on
female fertility, embryofetal development and post-natal development (up to weaning)
in rats. Pregnancy category B1 is considered acceptable.
19
•
Short term protection studies, lack of pharmacokinetic data for the S antigen-encoding
mRNA (BNT162b2 V9), suboptimal dosing interval in the repeat dose study, lack of
repeat dose toxicity studies in a second species and genotoxicity studies with the novel
excipients, and lack of studies investigating potential for autoimmune diseases were
noted. However, these deficiencies are either adequately justified by the sponsor or
addressable by clinical data.
•
There are no nonclinical objections to the provisional registration of the vaccine. Long
term immunity and vaccine induced autoimmune diseases were not studied in the
nonclinical program and should be addressed by clinical data post provisional
registration. Nonclinical studies on complement activation and stimulation of cytokine
release are recommended unless these issues are addressed by clinical data.
Clinical
Studies providing clinical data
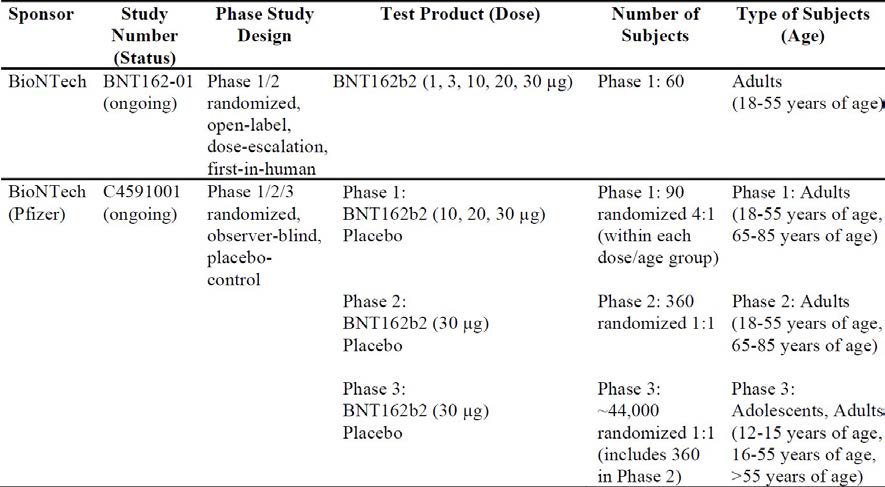
The submission included study reports for Study BNT162-01 and Study C4591001. The
following table presents the summary of the two clinical studies.
Table 3: Summary of the clinical studies
Study BNT162-01
Study BNT162-01 is a Phase I/II, first in human (FIH) study conducted in Germany, which
explored various vaccine candidates and dose levels. Of note, cell mediated immunity data
19
Australian pregnancy category B1: Drugs which have been taken by only a limited number of pregnant
women and women of childbearing age, without an increase in the frequency of malformation or other direct
or indirect harmful effects on the human fetus having been observed.
Studies in animals have not shown evidence of an increased occurrence of fetal damage.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 15 of 42
FINAL 25 January 2021
link to page 16
Therapeutic Goods Administration
are available from this study in a limited number of subjects aged 18 to 55 years. Based on
the enzyme-linked immune absorbent spot (ELISpot) and intracellular cytokine staining
(ICS) assay results, BNT162b1 and BNT162b2 induced poly-functional and
pro-inflammatory cluster of differentiation (CD)4+/CD8+ T cell responses in most study
participants. Re-stimulation of peripheral blood mononuclear cel s (PBMCs) with peptide
pools representing the encoded antigens (receptor-binding domain (RBD) or full-length S
protein) demonstrated a helper response characterised by a robust interferon gamma
(IFNγ)/interleukin 2 (IL-2) response and only minor interleukin 4 (IL-4) production. This
cytokine profile indicates a favourable T helper cell type 1 (Th1) response and only a
minimal T helper cell type 2 (Th2) immune response.
This study contributed to the selection of vaccine candidate and the final dose. This study
is not discussed in detail in this AusPAR.
Study C4591001
Study C4591001 is a global, Phase I/II/III, randomised, multinational, placebo control ed,
observer blind study, conducted in healthy individuals. It began as a Phase I/II study in the
USA, and was later amended and expanded to a global Phase II/III study, enrolling
approximately 44,000 participants for immunogenicity, safety, and efficacy assessment.
Adolescents 12 to 17 years of age were later added. There were many protocol
amendments, but the amendments are considered justified and are unlikely to affect the
study conclusion. The study consists of multiple phases, these are:
•
Phase I (to identify preferred vaccine candidate and dose level).
•
Phase II (safety and immunogenicity in the first 360 participants who entered Phase
II/III).
•
Phase II/III (efficacy and safety evaluation of the selected vaccine in a larger
population).
The sponsor claimed that the clinical trials included in the application were performed in
accordance with Good Clinical Practice (GCP).
20
Immunogenicity
Study C4591001 Phase I immunogenicity
The Phase I part evaluated the safety, tolerability, and immunogenicity of two vaccine
candidates. Participants were randomised 4:1 to receive active vaccine or placebo. The
following two vaccine candidates were administered by the intramuscular (IM) route in a
two dose regimen:
•
Vaccine candidate
BNT162b1 (dose levels: 10, 20, 30, 100 µg), containing modRNA
encoding SARS-CoV-2 receptor-binding domain.
•
Vaccine candidate
BNT162b2 (dose levels: 10, 20, 30 µg), containing modRNA
encoding SARS-CoV-2 S protein (note, this is the vaccine candidate subsequently
chosen as the proposed product).
For each of the 2 candidates evaluated, younger participants (18 to 55 years old) received
escalating dose levels (N = 15 per dose level, 4:1 randomisation ratio between vaccine and
placebo) with progression to subsequent dose levels, and the older age group (65 to
85 years old, N = 15 per dose level, 4:1 randomisation ratio between vaccine and placebo)
20 The
Guideline for Good Clinical Practice (
GCP) is an international y accepted standard for the designing,
conducting, recording and reporting of clinical trials. The Guideline for Good Clinical Practice is incorporated
by reference in the Therapeutic Goods Regulations 1990. Compliance with the Guideline is a condition of
approval for the conduct of a clinical trial.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 16 of 42
FINAL 25 January 2021
link to page 23
Therapeutic Goods Administration
when safety data for the preceding groups were deemed acceptable by the independent
review committee.
A total of 90 subjects were involved in the Phase I assessment of BNT162b2 (mRNA).
SARS-CoV-2 neutralising titres and immunoglobulin G (IgG) antigen-binding levels
(S1 binding IgG and RBD binding IgG) were measured on Days 7 and 21 after Dose 1
(pre-Dose 2); Days 7 and 14, and 1 month after Dose 2. The results of Phase I
immunogenicity showed the following.
In the younger age group (18 to 55 years of age):
•
At 7 days after Dose 2, SARS-CoV-2 50% neutralising geometric mean titres (GMTs) in
the 20 µg and 30 µg dose groups were higher for BNT162b2 recipients than for
BNT162b1 recipients. The GMTs were similar in the 10 µg dose group for both
recipients. At 1 month after Dose 2 (Day 52), GMTs remained substantially higher than
those at the earlier time points after Dose 1 for both BNT162b1 and BNT162b2
recipients.
•
From before vaccination to 7 days post Dose 2, geometric mean fold rises (GMFRs) of
SARS-CoV-2 50% neutralising titres were substantially high (compared to earlier time
points after Dose 1) for BNT162b1 and BNT162b2 recipients at the 30 µg dose.
•
From before vaccination to 7 days after Dose 2, all participants at the 30 µg dose level
who received BNT162b1 or BNT162b2 achieved a ≥ 4 fold rise in SARS-CoV-2 50%
neutralising titres.
In the older age group (65 to 85 years of age):
•
At 7 days after Dose 2, SARS-CoV-2 50% neutralising GMTs in the 30 µg dose group
were higher for BNT162b2 recipients than for BNT162b1 recipients. At 1 month after
Dose 2 (Day 52), the SARS-CoV-2 50% neutralising GMTs in the 30 µg dose group were
similar for both BNT162b1 and BNT162b2 recipients.
•
From before vaccination to 7 days after Dose 2, the GMFR of SARS-CoV-2 50%
neutralising titres were substantially high (compared to earlier time points after
Dose 1) for BNT162b1 and BNT162b2 recipients at the 30 µg dose level.
•
From before vaccination to 7 days after Dose 2, most participants who received
BNT162b1 or BNT162b2 at the 30 µg dose level achieved a ≥ 4 fold rise in SARS-CoV-2
50% neutralising titres.
The immunogenicity results from the Phase I part demonstrated that BNT162b2 elicited
robust SARS-CoV-2 neutralisation and S1-binding IgG antibody levels in both younger and
older adults. Immune responses were generally stronger in the younger group than in the
older group. The neutralising titre GMTs were higher than those observed in a healthy
convalescent serum panel from people recovered from COVID-19. Responses were evident
after the first dose and substantially boosted after the second dose. The results support
the need for a 2 dose regimen. Safety and tolerability data of the Phase I part is described
in the
‘Safety’ section, below. The safety data demonstrated that the reactogenicity profile
of BNT162b2 is more favourable than BNT162b1 in both younger and older adults.
BNT162b2 at the 30 µg dose level was therefore selected for the Phase II/III part of this
study
.
Study C4591001 Phase II immunogenicity
The Phase II part of Study C4591001 commenced with selected candidate BNT162b2 at the
30 µg dose level administered to participants who were randomised 1:1 to receive vaccine or
placebo. The Phase II portion evaluated immunogenicity and reactogenicity for 360
participants enrolled into the study when the Phase II/III part commenced. Immunogenicity
results from 360 participants demonstrated that BNT162b2 at 30 µg elicited robust SARS-
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 17 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
CoV-2 neutralisation and S1-binding IgG antibody responses at 1 month after Dose 2, similar
to those observed in Phase I part of the study. The neutralising titres and S1-binding
geometric mean concentrations (GMCs) were higher in the younger age cohort compared
with the older age cohort.
Efficacy
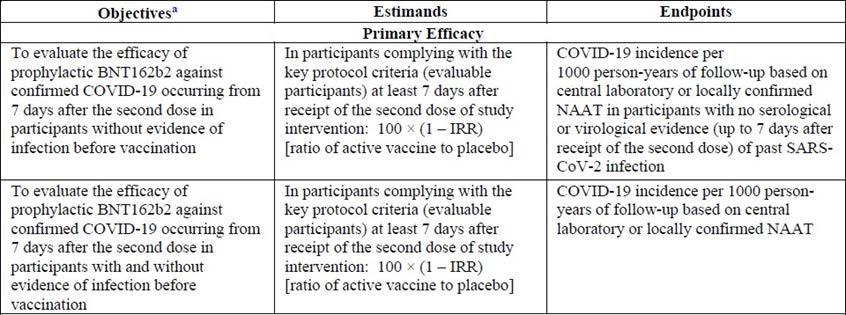
Study C4591001 Phase II/III objectives and endpoints
Phase II/III of Study C4591001 was designed to evaluate the safety and efficacy of
BNT162b2 at the 30 µg dose level, given in 2 doses each given21 days apart, in a larger
population.
Primary efficacy endpoints
The study objective and the two primary endpoints are described below in Table 4.
Table 4: Study C4591001 Phase II/III study objectives and primary efficacy
endpoints
a. Human immunodeficiency virus (HIV)-positive participants in Phase III were not included in analyses
of the objectives, with the exception of the specific exploratory objective. IRR = incidence rate ratio;
NAAT = nucleic acid amplification test, a biochemical technique used to detect a virus or a bacterium.
Secondary efficacy endpoints
The secondary efficacy endpoints, which were based on different approaches to COVID-19
case evaluation criteria, are described below:
•
COVID-19 confirmed at least 14 days after Dose 2: COVID-19 incidence per 1000
person years of follow up in participants either (1) without, or (2) with and without
serological or virological evidence of past SARS-CoV-2 infection before and during
vaccination regimen – cases confirmed ≥ 14 days after Dose 2.
•
Severe COVID-19: incidence per 1000 person years of follow up in participants either
(1) without, or (2) with and without evidence of past SARS-CoV-2 infection before and
during vaccination regimen – cases confirmed either (1) ≥ 7 days after Dose 2, or (2) ≥
14 days after Dose 2.
•
Centers for Disease Control and Prevention (CDC)-defined COVID-19: incidence
per 1000 person years of follow up in participants either (1) without, or (2) with and
without evidence of past SARS-CoV-2 infection before and during vaccination regimen
– cases confirmed either (1) ≥ 7 days after Dose 2, or (2) ≥ 14 days after Dose 2.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 18 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
Entry criteria
Participant selection: initial selection was for adults 18 years and older. The protocol was
later amended to include subjects 16 years and older, and then 12 years and older
(participants older than 18 years of age began enrolment from 27 July 2020, 16 to
17 years of age began from 16 September 2020 and 12 to 15 years of age began enrolment
from 15 October 2020). The sponsor does not seek indication for 12 to 15 years old, as the
number of subjects is limited at the time of submission. Healthy participants with
pre-existing stable disease, defined as disease not requiring significant change in therapy
or hospitalisation for worsening disease during the 6 weeks before enrolment, could be
included. Participants with known stable infection with HIV, hepatitis C virus or hepatitis
B virus could be included. It is noted that people with the following conditions were
excluded:
•
Other medical or psychiatric conditions, including recent or active suicidal
ideation/behaviour or laboratory abnormality that increased the risk of participation
or, in the investigator’s judgment, made the participant inappropriate for the study.
•
Immunocompromised individuals and individuals who received treatment with
immunosuppressive therapy.
•
Bleeding diathesis or condition associated with prolonged bleeding that would, in the
opinion of the investigator, contraindicate IM injection.
•
Participants who had previous clinical or microbiological diagnosis of COVID-19
disease.
•
History of severe adverse reaction associated with a vaccine and/or severe allergic
reaction to any component of the study intervention.
•
Women who are pregnant or breastfeeding.
The Phase II/III part is designed as an adaptive, event-driven trial. The 95.0% credible
interval for vaccine efficacy (VE) and the probability of VE greater than 30% were
calculated with the use of a Bayesian beta-binomial model. The final analysis uses a
success boundary of 98.6% for probability of vaccine efficacy greater than 30%, to
compensate for the interim analysis and to control the overall Type 1 error rate at 2.5%.
Confirmed COVID-19 cases were determined by reverse transcription-polymerase chain
reaction (RT-PCR) and required at least 1 symptom consistent with COVID-19 disease. The
symptoms included: fever, new or increased cough, new or increased shortness of breath,
chills, new or increased muscle pain, new loss of taste or smell, sore throat, diarrhoea or
vomiting.
Approximately 44,000 participants were enrolled and randomised 1:1 to receive 2 doses
of the vaccine or placebo, separated by 21 days. Randomisation was stratified by age:
16 through 55 years of age, or 56 years of age and older, with a minimum of 40% of
participants in the ≥ 56 year of age stratum. Note that subjects 12 through 15 years of age
were not included in the efficacy analysis.
Disposition and demographic characteristics of the study population
The proportions of all randomised participants (n = 43,651) included in the efficacy
analysis were similar in the BNT162b2 and placebo groups. Most participants who were
excluded from the evaluable efficacy population had not received all vaccinations as
randomised or did not receive Dose 2 within the predefined window (that is, 19 to 42 days
after Dose 1). The evaluable efficacy population includes 82.8% White, 8.9% Black or
African American and 4.5% Asian. 26.8% of participants were of Hispanic/Latino
ethnicity.. The median age was 52 years of age and participants were balanced for gender.
The younger (16 to 55 years of age) and older (> 55 years of age) groups comprised 57.2%
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 19 of 42
FINAL 25 January 2021
link to page 20
Therapeutic Goods Administration
and 42.6% of participants, respectively. Obese participants made up around 35% of the
population. Approximately 20% of participants had baseline comorbidities.
Results
Results of the first primary endpoint
The interim analysis (dated 4 November 2020) based on 94 COVID-19 cases successfully
demonstrated high VE. This was followed by the second (and final) analysis, which was
based on 170 accumulated COVID-19 cases. The final analysis was performed on 14
November 2020, by which time 43,651 participants had been randomised. The focus of
this section will be the final efficacy analysis.
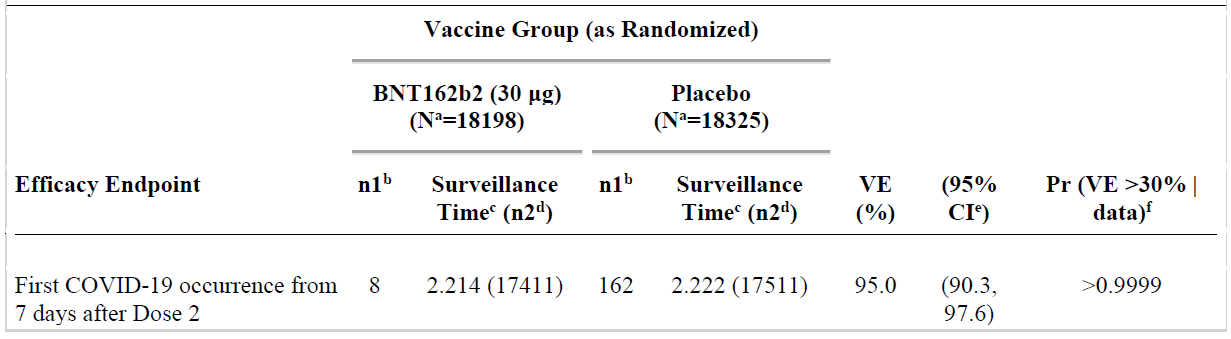
Results of the first primary endpoint (vaccine efficacy without prior evidence of
SARS-CoV-2 infection, 7 days after Dose 2, final analysis) are shown in
Table 5. Among the 36,523 efficacy evaluable participants who had no evidence of existing or prior
SARS-CoV-2 infection (18,198 in the vaccine group and 18,325 in the placebo groups),
8 cases of COVID-19 with onset at least 7 days after the second dose were observed among
vaccine recipients and 162 among placebo recipients. The VE against confirmed COVID-19
occurring at least 7 days after Dose 2 was 95.0%. The 95% confidence interval (CI) was
90.3% to 97.6%, indicating that the true VE is at least 90.3% with a 97.5% probability
given the observed data.
Table 5: Study C4591001 Phase II/III Vaccine efficacy, first COVID-19 occurrence
from 7 days after Dose 2 in subjects without evidence of infection prior to 7 days
after Dose 2 (efficacy evaluation (7 days) population)
Abbreviations: Pr = posterior probability; VE = vaccine efficacy; CI = confidence intervals
Note: Subjects who had no serological or virological evidence (prior to 7 days after receipt of the last
dose) of past SARS-CoV-2 infection (that is, SARS-CoV-2 nucleoprotein-binding (N-binding) antibody
(serum) negative at Visit 1 and SARS-CoV-2 not detected by nucleic acid amplification test (NAAT) via
nasal swab sample at Visits 1 and 2), and had negative NAAT (nasal swab) at any unscheduled visit prior
to 7 days after Dose 2 were included in the analysis. Data cut-off date: 14 November 2020.
a. N = number of subjects in the specified group. b. n1 = Number of subjects meeting the endpoint
definition. c. Total surveil ance time in 1000 person-years for the given endpoint across al subjects
within each group at risk for the endpoint. Time period for COVID-19 case accrual is from 7 days after
Dose 2 to the end of the surveil ance period. d. n2 = Number of subjects at risk for the endpoint. e.
Credible interval for VE was calculated using a beta-binomial model with prior beta (0.700102, 1)
adjusted for surveil ance time. f. Pr was calculated using a beta-binomial model with prior beta
(0.700102, 1) adjusted for surveil ance time.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 20 of 42
FINAL 25 January 2021
link to page 21 link to page 21 link to page 21
Therapeutic Goods Administration
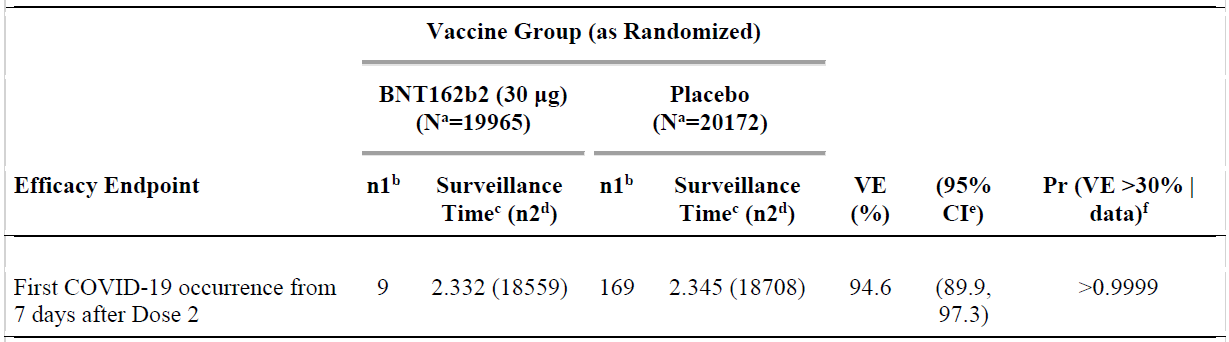
Results of the second primary efficacy endpoint
Table 6: Study C4591001 Phase II/III Vaccine efficacy, first COVID-19 occurrence
from 7 days after Dose 2 in subjects with or without evidence of infection prior to
7 days after Dose 2 (efficacy evaluation (7 days) population)
Data cut-off date: 14 November 2020.
a. N = number of subjects in the specified group. b. n1 = Number of subjects meeting the endpoint
definition. c. Total surveil ance time in 1000 person-years for the given endpoint across al subjects
within each group at risk for the endpoint. Time period for COVID-19 case accrual is from 7 days after
Dose 2 to the end of the surveil ance period. d. n2 = Number of subjects at risk for the endpoint. e.
Credible interval for VE was calculated using a beta-binomial model with prior beta (0.700102, 1)
adjusted for surveil ance time. f. Pr was calculated using a beta-binomial model with prior beta
(0.700102, 1) adjusted for surveil ance time.
Vaccine efficacy by subgroups
For the primary endpoints, VE was evaluated for subgroups by age, gender; race, ethnicity,
and country. Among participants without prior evidence of SARS-CoV-2 infection, VE was
> 93% in all subgroups, with the exception of the ‘All others’ race group (89.3%);
21 and
Brazil (87.7%). The VE was 94.7% (95% CI: 66.7%, 99.9%) in participants older than
65 years of age (1 case in the BNT162b2 group versus 19 cases in the placebo group).
An additional analysis of age subgroups showed observed VE in those older than 75 years
of age was 100 % (0 cases in the BNT162b2 group versus 5 cases in the placebo group
(95% CI: -13.1%, 100.0%).
Among participants with or without prior evidence of SARS-CoV-2 infection, VE was
> 93% in all subgroups, with the exception of the ‘All others’ race group (78.2%
),21 Brazil
(75.4%), and positive prior SARS-CoV-2 infection at Baseline (-7.1%, 1 case in each group).
Post hoc subgroup analyses by risk status
Post hoc analyses of efficacy based on risk status were performed. Among participants
without prior evidence of SARS-CoV-2 infection before and during vaccination regimen,
VE for at risk participants was 95.3%, as compared with 94.7% for those not at risk
.22
VE for participants ≥ 65 years of age and at-risk was 91.7%, as compared with 100% for
those ≥ 65 years of age and not at-risk. VE was similar in obese (95.4%) and non-obese
(94.8%) participants.
Results for the secondary efficacy endpoints
The observed VE against confirmed COVID-19 occurring at least 14 days after Dose 2 in
participants without evidence of SARS-CoV-2 infection before and during the vaccination
regimen was 94.2%, with 8 and 139 cases in the BNT162b2 and placebo groups,
respectively. The posterior probability of > 99.99% for the true VE > 30% met the
21 All others = American Indian or Alaska native, Asian, Native Hawaiian or other Pacific Islander, multiracial,
and not reported race categories.
22 ‘At risk’ is defined as having at least one of the Charlson Comorbidity Index category or obesity (body mass
index ≥ 30 kg/m2).
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 21 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
pre-specified success criterion of > 98.6% for this endpoint. The 95% CI for the vaccine
efficacy was 88.7% to 97.2%.
Among participants with or without evidence of SARS-CoV-2 infection before and during
vaccination regimen, VE against confirmed COVID-19 occurring at least 14 days after
Dose 2 was 94.4%, with 8 and 144 cases in the BNT162b2 and placebo groups,
respectively. The posterior probability of > 99.99% for the true VE > 30% met the
pre-specified success criterion of > 98.6% for this endpoint. The 95% CI for the vaccine
efficacy was 89.1% to 97.3%.
Among participants without evidence of SARS-CoV-2 infection before and during the
vaccination regimen, the observed VE of 66.3 % against severe COVID-19 occurring at
least 7 days after Dose 2 did not meet the pre-specified success criterion of the posterior
probability > 98.6%, due to the small numbers of severe cases (1 in the BNT162b2 group,
and 3 in the placebo group) observed after Dose 2 in the study. Additional analysis
conducted in all cases after Dose 1 (1 versus 9 cases, respectively) showed the evidence of
an effect on severe cases (VE = 88.9% with a 95% CI of 20.1 to 99.7%).
The efficacy analyses using CDC-defined symptoms to identify a COVID-19 case gave
similar efficacy results as the primary endpoints.
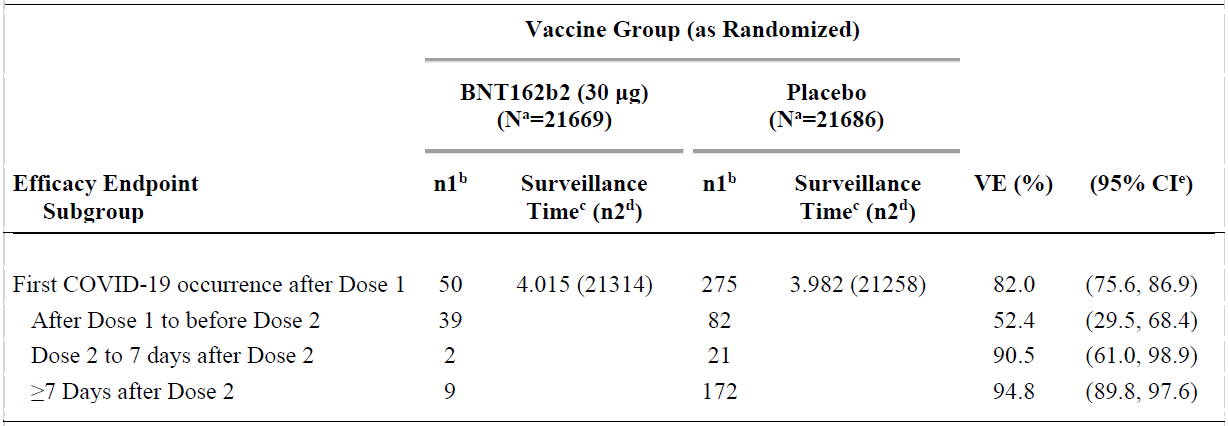
All confirmed cases of COVID-19 after Dose 1 (post-hoc analysis)
All reports of COVID-19 with onset at any time after Dose 1 are presented in the table
below.
Table 7: Study C4591001 Phase II/III Vaccine efficacy, first COVID-19 occurrence
after Dose 1 (Dose 1 all available efficacy population)
Data cut-off date: 14 November 2020.
a. N = number of subjects in the specified group. b. n1 = Number of subjects meeting the endpoint
definition. c. Total surveil ance time in 1000 person-years for the given endpoint across al subjects
within each group at risk for the endpoint. Time period for COVID-19 case accrual is from Dose 1 to the
end of the surveil ance period. d. n2 = Number of subjects at risk for the endpoint. e. Confidence interval
(CI) for VE is derived based on the Clopper and Pearson method (adjusted for surveil ance time for
overal row).
This provides a summary of cases for all participants in the Dose 1 all-available efficacy
population, regardless of evidence of infection before or during the vaccination regimen.
Among these participants, 50 cases of COVID-19 occurred after Dose 1 in the BNT162b2
group compared to 275 cases in the placebo group. The estimated VE against confirmed
COVID-19 occurring after Dose 1 was 82% (95% CI: 75.6%, 86.9%), with an estimated VE
of 52.4% (95% CI: 29.5%, 68.4%) against confirmed COVID-19 occurring after Dose 1 but
before Dose 2.
The early onset of protection can be observed in the cumulative incidence for the first
COVID-19 occurrence after Dose 1 among all vaccinated participants based on Dose 1 all-
available efficacy population. Disease onset appears to track together for BNT162b2 and
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 22 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
placebo until approximately 14 days after Dose 1, at which point the curves diverge, with
cases steadily accumulating in the placebo group, while remaining virtually flat in the
BNT162b2 group.
Safety
Safety was evaluated in Study BNT162-01 (FIH) and in three phases of Study C4591001.
This following sections focus on the safety analysis of Study C4591001. The safety
analyses are descriptive with no formal statistical hypothesis testing. The cut-off date for
safety data is 14 November 2020.
Study C4591001 Phase I
The 10 µg, 20 µg, and 30 µg doses tested for the vaccine candidates BNT162b1 and
BNT162b2 were well tolerated. The BNT162b1 candidate at 100 µg was discontinued after
the first dose due to the reactogenicity profile. Reactogenicity was generally higher after
Dose 2 than Dose 1. The frequency of local and systemic reactogenicity was generally
lower for BNT162b2 compared to BNT162b1, especially after the second dose.
Reactogenicity events after administration of each dose for both vaccine candidates in
older adults were milder and less frequent than those observed in younger adults. The
majority of events were mild or moderate. There were no serious adverse events (SAEs)
or discontinuations because of adverse events (AEs). Overall, fewer AEs were experienced
by participants who received BNT162b2 compared with those who received BNT162b1,
with the least number of participants experiencing AEs in the BNT162b2 older age group.
Clinical laboratory evaluations showed a transient decrease in lymphocytes that was
observed in all age and dose groups after Dose 1, which resolved within a few days, and
was not associated with any other clinical sequelae.
The report received by TGA on 10 December 2020 included additional follow-up from
1 month after Dose 2 (29 August 2020) to 4 months after Dose 2 (the data cut-off
14 November 2020): 1 severe SAE (neuritis; due to an antecubital fossa blood draw) was
reported in the younger age group. No additional AEs were reported in the younger or
older age group between 29 August 2020 to the data cut-off date of 14 November 2020.
Study C4591001 Phase II/III
The safety analysis has been done on all enrolled participants (n = 43,252);
the reactogenicity subset (n = 8,183); participates with a fol ow up more than 2 months
after Dose 2 (n = 19,037); and participants with a median follow up of 2 months after Dose
2. This section focuses on the safety analysis of the following:
•
local and systemic reactogenicity in the reactogenicity subset of 8,183 subjects; and
•
AE analysis in around 38,000 participants with a median of 2 months follow up post
Dose 2.
The primary safety endpoints were solicited, specific local or systemic AEs and use of
antipyretic or pain medication within 7 days after each dose of vaccine or placebo, as
prompted by and recorded in an electronic diary in a subset of participants (reactogenicity
subset), and unsolicited AEs (without prompts from the electronic diary) through 1 month
after the second dose, and through 6 months after the second dose.
Demographic characteristics of the approximately 38,000 participants with a median of
2 months of follow up after Dose 2 were similar between BNT162b2 and placebo groups.
There were no clinically meaningful differences by age, gender, race, ethnicity, or baseline
SARS-CoV-2 status in the vaccine and placebo groups. Across the two groups, about 20.5%
had any comorbidity. The most frequently reported comorbidities were diabetes (8.4%)
and pulmonary disease (7.8%), which were reported at similar frequencies in each group.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 23 of 42
FINAL 25 January 2021
link to page 24 link to page 25
Therapeutic Goods Administration
Reactogenicity subset analysis
As of 14 November 2020, the reactogenicity subset was comprised of 8,183 participants
(which included the 360 participants in Phase II).
Local reactions
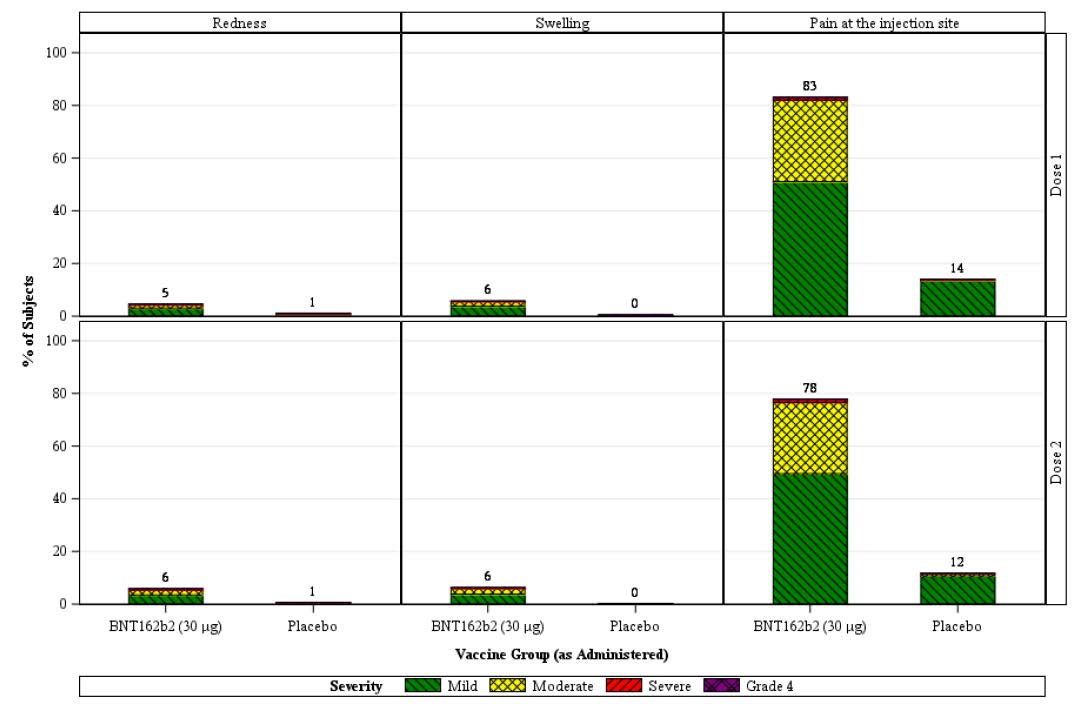
In the BNT162b2 group, pain at the injection site was reported more frequently in the
younger group (see
Figure 1) than in the older group (se
e Figure 2) with similar frequency
after Dose 1 and Dose 2 of BNT162b2 in the younger group (83.1% versus 77.8%) and
older group (71.1% versus 66.1%).
In the BNT162b2 group, frequencies of redness and swelling were similar in the younger
and older age group after Doses 1 and 2. Frequencies of redness were similar after Dose 1
and Dose 2 of BNT162b2 in the younger age group (4.5% versus 5.9%) and in the older
age group (4.7% versus 7.2%). Frequencies of swelling were similar after Dose 1 and
Dose 2 of BNT162b2 in the younger age group (5.8% versus 6.3%) and in the older age
group (6.5% versus 7.5%). In the placebo group, redness and swelling were reported
infrequently in the younger (≤ 1.1%) and older (≤ 1.2%) groups after Doses 1 and 2.
Across age groups, pain at the injection site did not increase after Dose 2, and redness and
swelling were generally similar in frequency after Dose 1 and Dose 2. Most local reactions
were mild or moderate. Few severe local reactions were reported after either dose. The
frequency of any severe local reactions after Dose 1 and after Dose 2 was ≤ 0.7%. No
Grade 4 reactions were reported. The local reactions for the BNT162b2 group after either
dose had a median onset between Day 1 and Day 3, and ranges were similar in the
younger and older age groups. The local reactions after either dose resolved with median
durations between 1 to 2 days, which were similar in the younger and older age groups.
Figure 1: Study C4591001 Phase II/III Participants aged 16 to 55 years reporting
local reactions, by maximum severity, within 7 days after each dose (reactogenicity
subset, safety population)
Note: the number above each bar denotes the percentage of subjects reporting the reaction with any
severity.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 24 of 42
FINAL 25 January 2021
link to page 26 link to page 26 link to page 26 link to page 26
Therapeutic Goods Administration
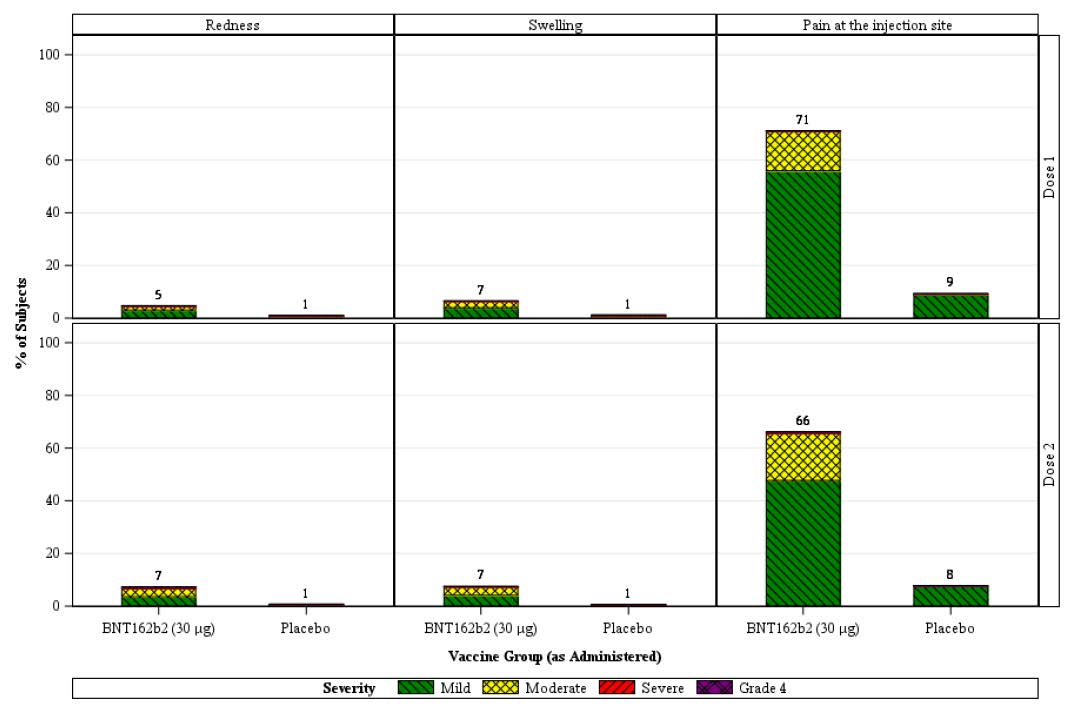
Figure 2: Study C4591001 Phase II/III Participants aged > 55 years reporting local
reactions, by maximum severity, within 7 days after each dose (reactogenicity
subset, safety population)
Note: the number above each bar denotes the percentage of subjects reporting the reaction with any
severity.
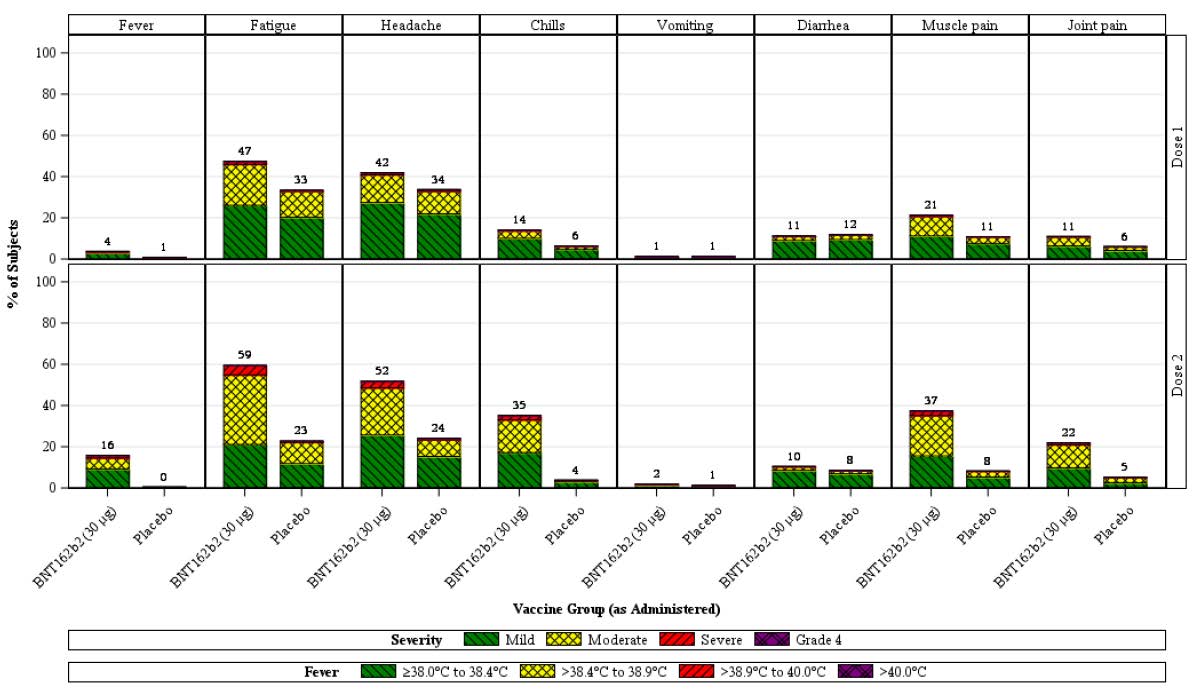
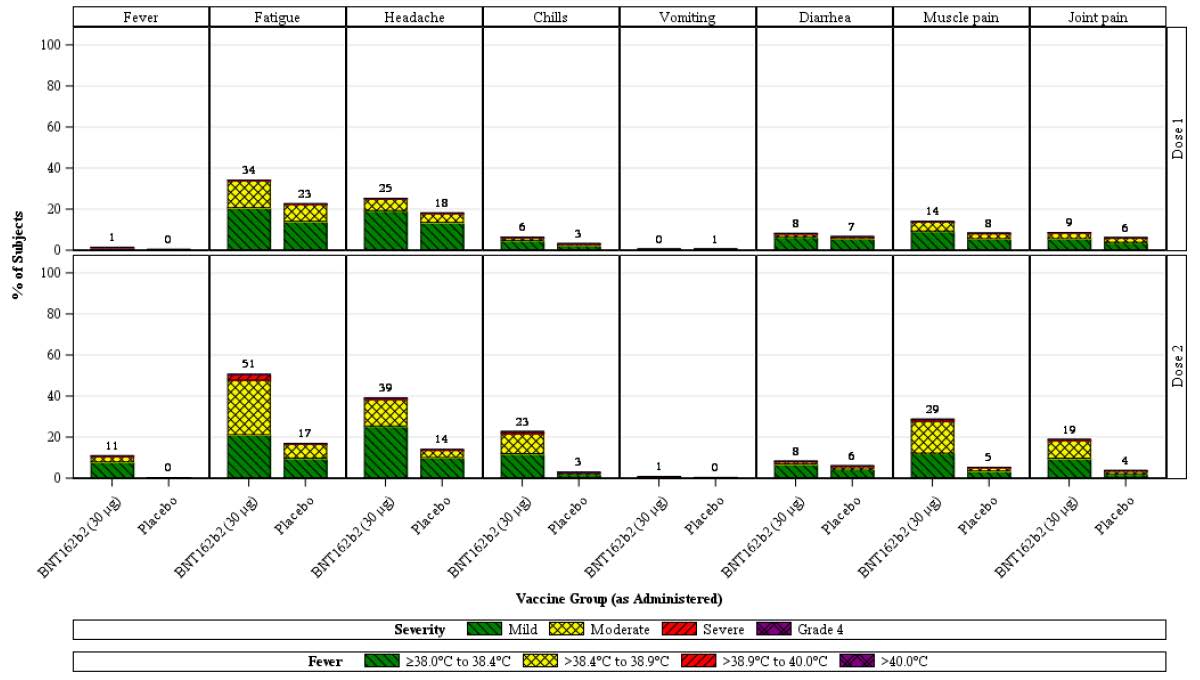
Systemic reactions
Systemic events were generally increased in frequency and severity in the younger age
group (s
ee Figure 3) compared with the older age group (s
ee Figure 4), with frequency
and severity increasing with number of doses (Dose 1 versus Dose 2). Vomiting and
diarrhoea were exceptions, with vomiting reported similarly infrequently in both age
groups and diarrhoea reported at similar incidences after each dose. Systemic events were
reported less frequently in the placebo group than in the BNT162b2 group, for both age
groups and doses, with some exceptions. In the younger age group, vomiting and
diarrhoea (after Dose 1 and Dose 2) were reported at similar frequencies in the placebo
group and the BNT162b2 group
(Figure 3). In the older age group, fever and joint pain
(after Dose 1) and vomiting and diarrhoea (after Dose 1 and Dose 2) were reported at
similar frequencies in the placebo group and the BNT162b2 group
(Figure 4).
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 25 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
Figure 3: Study C4591001 Phase II/III Participants aged 16 to 55 years reporting
systemic events, by maximum severity, within 7 days after each dose (reactogenicity
subset, safety population)
Note: the number above each bar denotes the percentage of subjects reporting the reaction with any
severity.
Figure 4: Study C4591001 Phase II/III Participants aged > 55 years reporting
systemic events, by maximum severity, within 7 days after each dose (reactogenicity
subset, safety population)
Note: the number above each bar denotes the percentage of subjects reporting the reaction with any
severity.
In the BNT162b2 group, systemic events after Dose 1 were generally lower in frequency
than after Dose 2 across age groups: fever (2.7% versus 13.6%), fatigue (41.5% versus
55.5%), headache (34.5% versus 46.1%), chills (10.6% versus 29.6%), muscle pain
(18.0% versus 33.5%), and joint pain (9.9% versus 20.5%). Diarrhoea and vomiting
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 26 of 42
FINAL 25 January 2021
link to page 27
Therapeutic Goods Administration
frequencies were generally similar. Across age groups, the median onset day for all
systemic events after either Dose 1 or 2 of BNT162b2 was Day 2 to Day 3, and ranges were
similar in the younger and older age subgroups. All systemic events resolved with
a median duration of 1 day, which was similar in the younger and older age subgroups.
The median duration of either fever or chills from first to last day after Dose 1 and Dose 2
was 1 day, for both younger and older age subgroups. Other than fatigue and headache,
most systemic events were infrequent in the placebo group.
Analysis of adverse events
A total of 37,707 participants who were randomised on or before 9 October 2020 were
vaccinated with Dose 1. One of these participants did not sign an informed consent and is
therefore not included in any analysis population. The remaining 37,706 participants had
a median follow up time of 2 months after Dose 2. Of these, 19,067 (50.6%) had at least
2 months of follow up after Dose 2. HIV positive participants (n = 120) were included for
counting purposes in demographic and disposition summaries; however, these
participants were not included in the summary of safety or efficacy endpoint results.
Therefore, 37,586 participants were included in the AE analyses presented here.
Among these 37,586 participants, the most frequent AEs reported up to 1 month after
Dose 2 were reactogenicity events, in the System Organ Classes (SOCs) o
f:23 •
general disorders and administration site conditions (18.6% BNT162b2 versus 3.9%
placebo)
•
musculoskeletal and connective tissue disorders (7.3% BNT162b2 versus 2.0%
placebo)
•
nervous system disorders (6.1% BNT162b2 versus 2.4% placebo)
•
infections and infestations (1.5% BNT162b2 versus 1.5% placebo)
•
gastrointestinal disorders (2.9% BNT162b2 versus 1.9% placebo).
Comparing the younger (aged 16 to 55 years) versus older (aged > 55 years) BNT162b2
age subgroups, AE incidences in these SOCs were:
•
general disorders and administration site conditions (21.1% versus 15.2%)
•
musculoskeletal and connective tissue disorders (8.3% versus 5.9%)
•
nervous system disorders (6.9% versus 4.9%)
•
infections and infestations (1.5% versus 1.6%)
•
gastrointestinal disorders (3.0% versus 2.8%).
The numbers of overall participants who reported at least one AE (27.0% versus 12.5%)
were higher in the BNT162b2 group as compared with the placebo group and at least one
related AE (20.8% versus 5.1%). The most frequent AEs in the BNT162b2 group were
injection site pain (2,108 (11.2%)), pyrexia (1,144 (6.1%)), chills (998 (5.3%)), fatigue
(1,026 (5.5%)), headache (966 (5.1%)), and myalgia (904 (4.8%)). During this time period
from Dose 1 to 1 month after Dose 2, most of these AEs were reported during the
electronic diary 7 day reporting period. The majority of these AEs were reported in the
younger age group: injection site pain (1,358 (12.5%)), pyrexia (819 (7.6%)), chills (693
(6.4%)), fatigue (690 (6.4%)), headache (649 (6.0%)), and myalgia (628 (5.8%)).
23 The
Medical Dictionary for Regulatory Activities (
MedDRA) is an international y used set of terms
relating to medical conditions, medicines and medical devices. It was created to assist regulators with sharing
information. It is also used by industry, academics, health professionals and other organisations that
communicate medical information. The MedDRA
System Organ Class (
SOC) is defined as the highest level of
the MedDRA terminology, distinguished by anatomical or physiological system, aetiology (disease origin) or
purpose. Most of these describe disorders of a specific part of the body.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 27 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
This trend continued to be seen through the data cut-off date for all enrol ed participants
(n = 43,252 participants). The higher frequency of reported unsolicited non-serious AEs
among BNT162b2 recipients compared to placebo recipients was primarily attributed to
local and systemic AEs reported during the first 7 days following vaccination that are
consistent with adverse reactions solicited among participants in the reactogenicity
subset.
Adverse events by subgroups
No clinically meaningful differences in AE frequencies were observed amongst age, sex,
race, ethnicity, or baseline SARS-CoV-2 status subgroups.
Adverse events of special interest
The CDC's list of adverse events of special interest (AESIs) for COVID-19, including the
terms potentially indicative of severe COVID-19 or serious autoimmune and
neuroinflammatory disorders, was considered in the review of reported AEs.
•
Lymphadenopathy: in the BNT162b2 group, 64 participants (0.3%) reported an AE
of lymphadenopathy (54 in the younger age group and 10 in the older age group), and
6 in the placebo group. In cases where location was specified, lymphadenopathy
occurred in the arm and neck region. Most lymphadenopathy events were reported
within 2 to 4 days after vaccination. The mean duration was 10 days and 12 events
were ongoing at the time of the data cut-off date. A total of 47 out of these
64 lymphadenopathy events were judged by the investigator as related to study
intervention.
•
Hypersensitivity: in the younger age group, an AE of angioedema 13 days after Dose 1
(both eyes) and hypersensitivity (allergy attack; no additional information available at
the time of this report) was reported in 1 participant each (both from the BNT162b2
group), and an AE of drug hypersensitivity (oral penicillin reaction) was reported in
1 participant who received placebo; all were assessed by the investigator as unrelated
to study intervention. There were 6 participants that reported ‘Drug hypersensitivity’
in the vaccine group compared to 1 in placebo group. Post-market monitoring for
hypersensitivity events should be conducted.
•
Facial paralysis: there were 4 reports of facial paralysis (Bell’s palsy) in the vaccine
group with none in the placebo group.
Serious adverse events
Among the 37,586 participants with a median of 2 months of follow up after Dose 2, from
Dose 1 to 1 month after Dose 2, the proportions of participants who reported at least
1 SAE was similar in the BNT162b2 group (0.5%) and in the placebo group (0.4%). Three
of the SAEs in the BNT162b2 group and none in the placebo group were assessed as
related to study intervention: 1 SAE each of shoulder injury related to vaccine
administration, ventricular arrhythmia, and lymphadenopathy.
A total of 12 participants had SAEs of appendicitis; 8 in the BNT162b2 group and 4 in the
placebo group. None were assessed as related to study intervention. An observation of
12 appendicitis events across both treatment groups is not greater than expected based on
background rates (estimated in a US Electronic Health Records database).
Up to cut-off date of 14 November 2020, the number of participants who reported SAEs
was similar in the two groups (0.7% for the BNT162b2 group versus 0.5% for the placebo
group). With the additional follow up time, another SAE assessed by the investigator as
related to study intervention in the BNT162b2 younger age subgroup was reported:
1 event of lower back pain and bilateral lower extremity pain with radicular paraesthesia
(onset Day 47 after Dose 2).
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 28 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
Severe AEs, SAEs, and AEs leading to withdrawal were few, and were reported by ≤ 1.2%,
≤ 0.5%, and ≤ 0.2% respectively, in both groups. Discontinuations due to related AEs were
reported in 14 participants in the BNT162b2 group and 7 participants in the placebo
group.
Deaths
There were 6 participants, all in Phase III part of the study, who died before the data
cut-off date of 14 November 2020. There were 2 deaths in the BNT162b2 group
(arteriosclerosis and cardiac arrest) and 4 deaths in the placebo group that were assessed
as not related to study intervention.
Severe COVID-19 illness
The protocol had pre-specified stopping rules that included monitoring of severe
COVID-19 cases, and these stopping criteria were not met. The confinement of the
majority of severe cases to the placebo groups suggests no evidence for vaccine-associated
enhanced disease (VAED), including vaccine-associated enhanced respiratory disease
(VAERD).
The safety profile of all enrolled participants (n = 43,252 participants) who had variable
follow up from Dose 1 to the data cut-off date (14 November 2020) is consistent with the
safety profile in the participants who had at least 2 months of follow up after Dose 2.
The safety evaluation is still ongoing. Participants continue to be monitored for unsolicited
AEs, including SAEs up to six months after the last vaccine dose.
Safety in special populations
•
Pregnant women: at the time of the data cut-off (14 November 2020), a total of
23 participants had reported pregnancies in the safety database, including
9 participants who withdrew from the vaccination period of the study due to
pregnancies. These participants continue to be followed for pregnancy outcomes. The
data to support safety in pregnancy are inadequate at this stage.
•
Paediatric population: there were only 100 participants between 12 to 15 years of
age (n = 49 BNT162b2; n = 51 placebo) recruited in the Phase II/III study under
protocol amendment 7. The safety and efficacy of BNT162b2 in participants < 16 years
of age have not been established. The sponsor is not seeking indication for < 16 years
old in the current submission, and will undertake further study in paediatric subjects
to assess the vaccine response in the paediatric population.
•
Immunocompromised individuals: immunocompromised individuals and
individuals who received treatment with immunosuppressive therapy were excluded
from the clinical trial. There were data for limited number of participants with stable
HIV infection.
Post-marketing adverse event reports
There were a number of reports of anaphylaxis reactions to the sponsor’s COVID-19
vaccine in the UK and in the USA following the vaccine rollout. The two cases in the UK
occurred on 8 December 2020. Both individuals in the UK had a history of severe allergic
reactions and carried adrenaline auto injectors. They both were treated and have
recovered.
Anaphylactic reaction is now included as an identified risk for this vaccine. The updated
Australian PI has an included statement of ‘
Close observation for at least 15 minutes is
recommended fol owing vaccination. A second dose of the vaccine should not be given to
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 29 of 42
FINAL 25 January 2021
link to page 9 link to page 30 link to page 30
Therapeutic Goods Administration
those who have experienced anaphylaxis to the first dose of Comirnaty’;24 and ‘
Appropriate
medical treatment and supervision should always be readily available in case of an
anaphylactic reaction following the administration of the vaccine’. Hypersensitivity to the
active substance or to any of the vaccine excipients have been included as
Contraindication. The US Food and Drug Administration (FDA) document for Health Care
Professionals include the statement of ‘
Do not administer Pfizer-BioNTech COVID- 19
Vaccine to individuals with known history of a severe allergic reaction (e.g., anaphylaxis) to
any component of the Pfizer-BioNTech COVID-19 Vaccine’.
25
Clinical evaluator’s recommendation
The product falls within the scope of provisional registration pathway (section 23AA of
the Ac
t),10 concerning provisional marketing authorisations, as Comirnaty is a new
biological entity which aims at the prevention of a life-threatening disease and the
preliminary clinical data demonstrating that the medicine is likely to provide a major
therapeutic advance.
From clinical point of view, the relevant data is limited to a single pivotal clinical trial,
Study C4591001, for which interim findings for a median follow up period of around
2 months only are available. Short follow up duration limits the conclusion on persistence
of efficacy and late onset/rare adverse events. This study is planned to continue for a total
of 24 months.
As comprehensive data on the product are not available, provisional registration is the
most appropriate regulatory pathway.
The clinical evaluator’s recommendation is that Comirnaty can have provisional approval
for:
Active immunisation to prevent coronavirus disease 2019 (COVID-19) caused by
SARS-CoV-2, in individuals 16 years of age and older.
As Comirnaty is being recommended for a provisional registration, the fol owing is the
recommendation regarding confirmatory trial data, as conditions of registration:
•
Submit the completed study report for Study C4591001 (Phase II/III) as soon it is
available. The sponsor should also submit safety data at 6 month follow up time. Since
this is a rolling submission, interim data can be submitted at any stage.
•
Submit the interim analysis and final clinical study reports for Study BNT162-01 once
completed, including data on healthy subjects.
•
Submit monthly, expedited summary safety reports for the next 6 months (risk
management plan (RMP) recommendation).
•
Routine submission of periodic benefit risk evaluation reports (PBRERs;
pharmacovigilance).
As and when available, further data related to vaccine efficacy in paediatric subjects,
pregnant women, in immunocompromised subjects, the data relating to protection against
asymptomatic disease and the information relating to post-market safety
and effectiveness studies should be submitted as separate submissions to amend the
current indications and to update the PI.
24 Sponsor clarification: fol owing the Advisory Committee meeting (see ‘Advisory Committee considerations’
section, below), this text was updated in the draft PI to read ‘The individual should be kept under close
observation for at least 15 minutes fol owing vaccination. A second dose of Comirnaty should not be given to
those who have experienced anaphylaxis to the first dose of Comirnaty.’
25 FDA, Fact Sheet for Healthcare Providers Administering Vaccine (Vaccination Providers) Emergency Use
Authorization (EUA) of the Pfizer-BioNTech COVID-19 Vaccine to Prevent Coronavirus Disease 2019 (COVID-
19), Last updated 6 January 2021. Available from the FDA website.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 30 of 42
FINAL 25 January 2021
link to page 31 link to page 31
Therapeutic Goods Administration
Risk management plan
On 10 December 2020, the sponsor submitted EU-RMP version 0.1 (date 29 November
2020; data lock point (DLP) 29 November 2020) in support of this application. On 29
December 2020, an updated version of the EU RMP, version 1.0 (dated 21 December 2020;
DLP 17 December 2020) was provided. On 6 January 2021, the sponsor provided the
Australian specific annex (ASA) version 0.1 (date 5 January 2021). On 18 January 2021,
the sponsor provided the ASA version 0.2 (date 17 January 2021).
The summary of safety concerns and their associated risk monitoring and mitigation
strategies are summarised i
n Table 8.26
Table 8: Summary of safety concerns
Summary of safety concerns
Pharmacovigilance
Risk minimisation
Routine Additional Routine Additional
Important
Anaphylaxis
†
*
–
identified
risks
Important
Vaccine-associated enhanced disease
†
*
–
–
potential
(VAED) including vaccine-associated
risks
enhanced respiratory disease (VAERD)
Missing
Use in pregnancy and while breast
*
–
information feeding
Use in immunocompromised patients
*
–
Use in frail patients with co-morbidities
*
–
(for example, chronic obstructive
pulmonary disease (COPD), diabetes,
chronic neurological disease,
cardiovascular disorders)
Use in patients with autoimmune or
*
–
–
inflammatory disorders
Interaction with other vaccines
*
–
Long term safety data
*
–
–
†Data capture Aid. *Clinical trials.
The summary of the safety concerns above is considered acceptable.
26
Routine risk minimisation activities may be limited to ensuring that suitable warnings are included in the
product information or by careful use of label ing and packaging.
Routine pharmacovigilance practices involve the fol owing activities:
• Al suspected adverse reactions that are reported to the personnel of the company are col ected and
col ated in an accessible manner;
• Reporting to regulatory authorities;
• Continuous monitoring of the safety profiles of approved products including signal detection and updating
of label ing;
• Submission of PSURs;
• Meeting other local regulatory agency requirements.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 31 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
With regards to additional pharmacovigilance activities, the sponsor has proposed the
following 11 studies, of which one is global, three are in Europe only, two are in Europe
and the US, and three are in the US only; the countries where two studies will be
conducted are not available at this time. There are six interventional studies
(Studies C4591001, C4591015, BNT162-01 Cohort 13, C4591018, one study in high risk
adults and one study for vaccine interactions) and five non-interventional studies (four
safety and one effectiveness).
Table 9: Planned studies that are considered additional pharmacovigilance
activities
The results from these studies will help to address the missing information identified in
the summary of safety concerns. The sponsor is also required to implement specific
targeted data capture aids to monitor AESIs in Australia.
No Australian specific studies have been planned. The data from the studies planned to be
conducted overseas are considered applicable to the Australian population.
As part of the conditions of registration outlined below, the sponsor is required to submit
monthly safety summary reports for the first 6 months of registration, and thereafter at
intervals specified by the TGA; and submit periodic safety updates reports (PSURs) six
monthly for 3 years, or the period of provisional registration whichever is longer.
Proposed risk management conditions of registration
•
The Comirnaty EU-RMP (version 1.0, dated 21 December 2020; DLP 17 December
2020), with Australian specific annex (version 0.2, dated 17 January 2021), included
with submission PM-2020-05461-1-2, and any subsequent revisions, as agreed with
the TGA will be implemented in Australia.
An obligatory component of risk management plans is routine pharmacovigilance.
Routine pharmacovigilance includes the submission of PSURs.
Unless agreed separately between the supplier who is the recipient of the approval
and the TGA, the first report must be submitted to TGA no later than six calendar
months after the date of the approval letter. The subsequent reports must be
submitted no less frequently than six monthly until the period covered by such reports
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 32 of 42
FINAL 25 January 2021
link to page 7 link to page 12
Therapeutic Goods Administration
is not less than three years from the date of the approval letter, or the entire period of
provisional registration, whichever is longer.
The reports are to at least meet the requirements for PSURs as described in the
European Medicines Agency’s Guideline on Good Pharmacovigilance Practices (GVP)
Module VII-periodic safety update report (Rev 1), Part VII.B Structures and processes.
Note that submission of a PSUR does not constitute an application to vary the
registration. Each report must have been prepared within ninety calendar days of the
data lock point for that report.
•
Additional to the routine submission of the routine PSURs, expedited monthly,
Comirnaty safety summary reports (including safety data for patients in Australia) are
to be provided for the first 6 months post registration, and thereafter at intervals
specified by the TGA.
•
Comirnaty is to be included in the Black Triangle Scheme due to provisional approv
al.2
The PI and Consumer Medicines Information (CMI) for Comirnaty must include the
black triangle symbol and mandatory accompanying text for the products entire
period of provisional registration.
Risk-benefit analysis
Delegate’s considerations
Unmet public health need
With respect to the incidence rate of COVID-19, Australia is currently in a better situation
in comparison to some other countries. However, the situation is far from the normal life
Australians led pre-COVID-19. The COVID-19 outbreaks have been occurring frequently,
and the consequential travel restriction and border closure have been having a negative
impact on our daily life. A safe and effective vaccine is one of the important tools in our
fight against the COVID-19 pandemic. No COVID-19 vaccine is currently registered in
Australia. There is an unmet need for safe and effective COVID-19 vaccines during the
current public health emergency.
Short term efficacy and safety data for provisional registration
The sponsor has submitted the short-term results from the pivotal study to support the
provisional registration of BNT162b2 (mRNA) COVID-19 vaccine. The submitted pivotal
study has an overall good study design, including representative study population and
acceptable statistical considerations. The results from this study have demonstrated that
BNT162b2 (mRNA) at 30 µg administered as a 2 dose schedule (21 days apart) achieved a
short term vaccine efficacy of 95% against polymerase chain reaction (PCR)-confirmed
COVID-19 in subjects ≥ 16 years of age without prior evidence of SARS-CoV-2 infection.
This was demonstrated in a larger randomised, placebo controlled Phase III trial, with
many subjects being followed up for a median of 2 months post Dose 2. The VE was
consistent across age, gender, race and ethnicity demographics. VE was also demonstrated
in those with one or more comorbidities. The analysis of tolerability and safety of the
vaccine detected short lived, mild to moderate local and systemic reactogenicity, a low
incidence of severe or serious events, and no clinical y significant safety concerns among
participants who were followed for a median of 2 months after the second dose of the
vaccine.
The submitted safety data is only short term at this stage, but the data have fulfilled the
requirement as set out in the ‘Access Consortium statement on COVID-19 vaccines
evidence
’.14 The statement specified the minimum requirement that trial participants must
be followed for a median of at least 2 months after receiving their final vaccine dose. It is
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 33 of 42
FINAL 25 January 2021
link to page 34
Therapeutic Goods Administration
acknowledged that most adverse reactions to vaccines occur within 4 to 6 weeks from
vaccination. The EMA has stated that conditional marketing authorisation for a COVID-19
vaccine could be based on review of at least 6 weeks post vaccination safety data.
27 From the perspective of vaccine efficacy, a 2 month median follow up is considered as the
shortest follow up period to achieve some confidence that any protection against
COVID-19 is likely to be more than short lived. The duration of protection is not yet known
and is to be assessed in the ongoing trial.
Data limitations
In addition to the unknown longer term safety and unknown duration of vaccine
protection, there are other limitations with the submitted data. The following questions
have not yet been addressed:
•
Vaccine efficacy against asymptomatic infection and viral transmission.
•
The concomitant use of this vaccine with other vaccines.
•
Vaccine data in pregnant women and lactating mothers.
•
Vaccine efficacy and safety in immunocompromised individuals.
•
Vaccine efficacy and safety in paediatric subjects (< 16 years old).
•
A correlate of protection has yet to be established. The vaccine immunogenicity cannot
be considered and used as the surrogate for vaccine protective efficacy at this stage.
Although the vaccine efficacies against certain outcomes have been demonstrated in the
pivotal study, the real world vaccine effectiveness when this vaccine is rolled out to a
larger and more diverse population is not known. The vaccine efficacy in the Aboriginal
and Torres Strait Islander population has not been studied. The sponsor has planned to
conduct at least one post-authorisation effectiveness study, a non-interventional study
(test negative design) of individuals presenting to the hospital or emergency room with
symptoms of potential COVID-19 illness in a real world setting (Study C4591014).
The proposed post-market studies will help to address the limitation of the current
information. Although no Australian specific studies have been planned, the data from the
studies planned to be conducted overseas are considered applicable to the Australian
population.
Pharmacovigilance and risk management plan
The sponsor has included the following as missing information in the updated EU-RMP
(version 1.0):
•
Use in pregnancy and while breast feeding.
•
Use in immunocompromised patients.
•
Use in frail patients with co-morbidities (for example, COPD, diabetes, chronic
neurological disease, cardiovascular disorders).
•
Use in patients with autoimmune or inflammatory disorders.
•
Interaction with other vaccines.
•
Long term safety data.
The sponsor has also included relevant statements in the PI to specify the populations
where the vaccine efficacy and safety data is to be further assessed.
27European Medicines Agency (EMA), Committee for Medicinal Product for Human Use (CHMP); EMA
Considerations on COVID-19 vaccine approval, EMA/592928/2020, 16 November 2020. Available from the
EMA website.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 34 of 42
FINAL 25 January 2021
link to page 30 link to page 13 link to page 13 link to page 32 link to page 32
Therapeutic Goods Administration
Anaphylactic reaction is now included as an identified risk for this vaccine. The updated PI
has included statement of ‘
Close observation for at least 15 minutes is recommended
fol owing vaccination. A second dose of the vaccine should not be given to those who have
experienced anaphylaxis to the first dose of Comirnaty’
;24 and ‘
Appropriate medical
treatment and supervision should always be readily available in case of an anaphylactic
reaction following the administration of the vaccine’. Hypersensitivity to the active
substance or to any of the vaccine excipients have been included as a Contraindication.
The sponsor has proposed the additional pharmacovigilance activities and post-market
studies to assess the vaccine in immunocompromised subjects, in paediatric subjects, and
in pregnant women. The Delegate is of the view that the proposed pharmacovigilance
activities and study plan is adequate to identify and characterise the risks of the vaccine.
A national coordinated traceability plan that covers the release by the manufacturer, the
entire distribution chain, prescription, dispensing and patient administration is to be
implemented by the Australian COVID-19 vaccine taskforce.
Proposed conditions of registration
Proposed quality conditions of registration are outlined in section
‘Proposed quality
conditions of registration’, above.
Proposed clinical conditions of registration are as follows:
•
The following study reports of the two ongoing studies will have to be submitted
before a definitive authorisation can be considered:
– Submit safety analysis at 6 months post Dose 2 from Study C4591001
(Phase II/III) when the analysis is available.
– Submit the final completed study report for Study C4591001 with 24 months
follow up duration when it becomes available.
– Submit final study reports for Study BNT162-01 once completed, including data on
healthy subjects.
When available, further data relating to vaccine efficacy against asymptomatic disease,
vaccine efficacy in immunocompromised subjects, paediatric subjects, pregnant
women, lactating mother, and the information relating to post-market safety and
effectiveness studies should be provided to the TGA to update the PI.
Proposed RMP conditions of registration are outlined in section
‘Proposed risk
management conditions of registration’, above.
Proposed action
Taking into consideration of the unmet public health need and the very high short term
efficacy with acceptable safety demonstrated in the submitted studies, the Delegate is of
the view that provisional registration of BNT162b2 (mRNA) COVID-19 vaccine is
appropriate for the use of this vaccine to prevent COVID-19 disease caused by SARS-CoV-2
virus in individuals 16 years of age and older. The pivotal study is ongoing for a total of
24 months. The longer-term efficacy and safety data are to be submitted to the TGA for
evaluation before a full registration can be considered.
Since the use of BNT162b2 (mRNA) COVID-19 vaccine is evaluated through the
provisional pathway, a clear statement should be included in the PI with regards to the
nature of the registration. It should also be emphasised that the decision of provisional
approval is made on the basis of short term efficacy and safety data, and the continued
approval depends on the evidence of longer term efficacy and safety from the ongoing and
post-market assessment.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 35 of 42
FINAL 25 January 2021
link to page 36 link to page 36
Therapeutic Goods Administration
The Delegate proposes the provisional approval of this vaccine for a revised indication,
and the sponsor has been requested to revise the indication to the following:
Comirnaty (BNT162b2 (mRNA)) COVID-19 Vaccine has provisional approval for
the indication below:
Active immunisation to prevent COVID-19 disease caused by SARS-CoV-2
virus in individuals 16 years of age and older.
The vaccine should be used in accordance with official guidance in an
officially declared pandemic.
The decision has been made on the basis of short term efficacy and safety data.
Continued approval depends on the evidence of longer term efficacy and safety from
the ongoing and post-market assessment.
Following the Delegate’s request, the sponsor submitted the updated PI on the
5 January 2021, with the indications revised to below:
Comirnaty (BNT162b2 (mRNA)) COVID-19 Vaccine has provisional approval for
the indication below:
Active immunisation to prevent coronavirus disease 2019 (COVID-19) caused
by SARS-CoV- 2, in individuals 16 years of age and older.
The use of this vaccine should be in accordance with official
recommendations.
The decision has been made on the basis of short term efficacy and safety data.
Continued approval depends on the evidence of longer term efficacy and safety from
ongoing clinical trials and post-market assessment.
The indication revised by the sponsor following TGA request was considered acceptable
by the Delegate.
The advice of the Advisory Committee on Vaccines (ACV) was requested for a number of
questions (see
‘Advisory Committee considerations’, below), including the advice and
comments on the indication wording.
Advisory Committee considerations28
The Advisory Committee on Vaccines (ACV), having considered the evaluations and the
Delegate’s overview, as well as the sponsor’s response to these documents, advised the
following.
28 The
Advisory Committee on Vaccines (ACV) provides independent medical and scientific advice to the
Minister for Health and the Therapeutic Goods Administration (TGA) on issues relating to the safety, quality
and efficacy of vaccines supplied in Australia including issues relating to pre-market assessment, post-market
monitoring and safe use in national immunisation programs.
The Committee is established under Regulation 39F of the Therapeutic Goods Regulations 1990 and the
members are appointed by the Minister for Health.
The ACV was established in January 2017, following consolidation of previous functions of the Advisory
Committee on the Safety of Vaccines (ACSOV) and the pre-market functions for vaccines of the Advisory
Committee on Prescription Medicines (ACPM).
Membership comprises professionals with expertise in specific scientific, medical or clinical fields, or
consumer health issues.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 36 of 42
FINAL 25 January 2021
link to page 37
Therapeutic Goods Administration
Specific advice to the Delegate
The ACV advised the following in response to the Delegate’s specific requests for advice.
1. Based on the evidence at this point in time, can the ACV advise whether the
benefits-risks balance is positive for the use of Comirnaty COVID-19 vaccine in
individuals 16 years of age and older in the Australian context to support the
provisional registration?
The ACV advised that the efficacy and safety data were sufficient to support provisional
registration of Comirnaty COVID-19 vaccine in individuals 16 years and older in the
Australian context.
There is limited or no information regarding patients with autoimmune or inflammatory
disorders, immunocompromised individuals, pregnant women and individuals with a
history of anaphylaxis. Clinical guidance will be required to assist individuals with
decision making.
2. Can the ACV comment on the indication proposed by the Delegate and the
indication revised by the sponsor?
The ACV supported the changes in product indication revised by the sponsor. The ACV
recommended to remove the condition ‘
in an officially declared pandemic’ from the
indication and agreed on Comirnaty (BNT162b2 (mRNA)) COVID-19 vaccine has
provisional approval for the indication below:
Active immunisation to prevent COVID-19 disease caused by SARS-CoV-2 virus in
individuals 16 years of age and older.
The use of this vaccine should be in accordance with official recommendations.
The decision has been made on the basis of short term efficacy and safety data.
Continued approval depends on the evidence of longer term efficacy and safety from
ongoing clinical trials and post-market assessment.
3. As the safety follow up is currently limited to a median of 2 months post Dose 2,
can the ACV comment on the likelihood of vaccine-related adverse events
occurring after more than 2 months post vaccination, particularly with the new
mRNA vaccine?
The ACV advised that it is unlikely for vaccine-related adverse events to occur more than
2 months after vaccination based on available data. However, there is limited information
on the use of mRNA vaccine in humans, which underpins the need for post market vaccine
safety surveillance.
4. Can the ACV comment on the proposed pharmacovigilance activities?
The ACV advised that the RMP is suitable with the addition of:
•
earlier conduct of co-administration study during the 2021 Southern Hemisphere
influenza vaccinations
•
vaccination errors should be reported, whether they resulted in adverse event or not
– there should be a systematic method to include and categorise error reports,
–
include an error surrogate as AESI, for example, shoulder injury related to vaccine
administration (SIRVA)
29
•
an AESI surveil ance plan should address
29 Refer to the ACV meeting statement for Meeting 11, 5 December 2018. Available from the TGA website at
https://www.tga.gov.au/committee-meeting-info/acv-meeting-statement-meeting-11-5-december-2018.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 37 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
– standard definitions
– background rates are critical for analysis and communication
– for some AESI, general practice datasets may provide more data than hospital
databases (for example, Bell’s Palsy)
•
surveillance should include all settings in which vaccine may be delivered including
aged care.
5. The Committee is also requested to provide advice on any other issues that it
thinks may be relevant.
Regarding the PI, the ACV advised:
•
‘Do not shake’ is critical to correct reconstitution of the vaccine. This warning needs
prominence. As this is a change to common clinical practices, supportive education by
other means is also needed.
•
Reiterate the importance of batch recording in the Australian Immunisation Register.
•
The minimum 15 minute observation period following administration should be
mandatory, not merely recommended.
Regarding the label, the ACV advised:
•
The expected labels refer to the FDA fact sheet, which currently permit the extraction
of six doses from the vial of reconstituted vaccine, compared to the five doses stated
on the label itself.
•
The Australian position will need to be clearly communicated.
Regarding the Consumer Medicines Information (CMI), the ACV advised consideration be
given to the following:
•
Relevant consumer information, whether as a CMI or in other information formats,
will be critical to informed consent in a campaign roll-out.
•
Consumer information should be frequently updated as information matures.
Consideration is required on how to ‘push’ updated information to consumers.
•
Provision of information on the impact of deferring or not having the second dose.
•
How and when to provide to consumers with information, especially regarding
pregnancy.
Conclusion
The ACV considered Comirnaty to have an overall positive benefit-risk profile, and
therefore supports provisional approval for the following:
Comirnaty (BNT162b2 (mRNA)) COVID-19 Vaccine has provisional approval for
the indication below:
Active immunisation to prevent coronavirus disease 2019 (COVID-19) caused
by SARS-CoV-2, in individuals 16 years of age and older.
The use of this vaccine should be in accordance with official
recommendations.
The decision has been made on the basis of short term efficacy and safety data.
Continued approval depends on the evidence of longer term efficacy and safety from
ongoing clinical trials and post-market assessment.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 38 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
Outcome
Based on a review of quality, safety and efficacy, the TGA approved the registration of
Comirnaty (BNT162b2 (mRNA)) 30 µg/0.3 mL concentrated suspension for injection vial,
indicated for:
Comirnaty (BNT162b2 (mRNA)) COVID-19 vaccine has provisional approval for the
indication below:
Active immunisation to prevent coronavirus disease 2019 (COVID-19) caused
by SARS-CoV-2, in individuals 16 years of age and older.
The use of this vaccine should be in accordance with official
recommendations.
The decision has been made on the basis of short term efficacy and safety data.
Continued approval depends on the evidence of longer term efficacy and safety from
ongoing clinical trials and post-market assessment.
Specific conditions of registration applying to these goods
•
Comirnaty vaccine is to be included in the Black Triangle Scheme due to provisional
approval. The PI and CMI for Comirnaty vaccine must include the black triangle
symbol and mandatory accompanying text for the products entire period of
provisional registration.
•
The Comirnaty EU-RMP (version 1.0, dated 21 December 2020; data lock point 17
December 2020), with Australian Specific Annex (version 0.2, dated 17 January 2021),
included with submission PM-2020-05461-1-2, and any subsequent revisions, as
agreed with the TGA will be implemented in Australia.
An obligatory component of risk management plans is routine pharmacovigilance.
Routine pharmacovigilance includes the submission of PSURs.
Unless agreed separately between the supplier who is the recipient of the approval
and the TGA, the first report must be submitted to TGA no later than six calendar
months after the date of the approval letter. The subsequent reports must be
submitted no less frequently than six monthly until the period covered by such reports
is not less than three years from the date of the approval letter, or the entire period of
provisional registration, whichever is longer.
The reports are to at least meet the requirements for PSURs as described in the
European Medicines Agency’s Guideline on Good Pharmacovigilance Practices (GVP)
Module VII-periodic safety update report (Rev 1), Part VII.B Structures and processes.
Note that submission of a PSUR does not constitute an application to vary the
registration. Each report must have been prepared within ninety calendar days of the
data lock point for that report.
•
Additional to the routine submission of the routine PSURs, expedited monthly,
Comirnaty safety summary reports (including safety data for patients in Australia) are
to be provided for the first 6 months post registration, and thereafter at intervals
specified by the TGA.
•
Clinical studies
The following study reports of the two ongoing studies will have to be submitted
before a definitive authorisation can be considered:
– Submit safety analysis at 6 months post Dose 2 from Study C4591001
(Phase II/III) when the analysis is available.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 39 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
– Submit the final completed study report for Study C4591001 with 24 months
follow up duration when it becomes available.
– Submit final study reports for Study BNT162-01 once completed, including data on
healthy subjects.
When available, further data relating to vaccine efficacy against asymptomatic disease,
vaccine efficacy in immunocompromised subjects, paediatric subjects, pregnant
women, lactating mother, and the information relating to post-market safety and
effectiveness studies should be provided to the TGA, as separate submissions, to
update the PI.
•
Medicine labels
– Unless otherwise agreed to by the Secretary following an application under Section
9D of the Act, the product must only be supplied with the following labels:
The international label, referred to here as the ‘US emergency use – 5 doses
labels’ as follows: A) carton label, B) vial label.
The international label, referred to here as the ‘US emergency use – 6 doses
labels’ as follows: A) carton label, B) vial label.
The international label, referred to here as the ‘Comirnaty-branded – 5 doses
labels’ as follows: A) carton label, B) vial label.
The international label, referred to here as the ‘Comirnaty-branded – 6 doses
labels’ as follows: A) carton label, B) vial label.
– The sponsor wil develop Australian-specific labels for the product, that conform
with all relevant Australian labelling requirements, and will take all reasonable
steps to implement such labelling before the end of the provisional registration
period referred to in subsection 29(3) of the Act (being the period of 2 years
starting on the day specified in the ARTG certificate of registration) (noting that,
consistent with paragraph 28(5)(aaa) of the Act, changes to such matters as labels
that have been agreed to as part of an evaluation under section 25 of the Act may
only occur following submission under section 9D of a 'variation' application and
approval by the TGA).
– The sponsor will provide information to the TGA on the proposed strategies and
planned timelines for Australian dedicated supplies, as soon as possible. Australian
specific labels will be implemented no later than 24 January 2023.
•
Batch release testing and compliance
It is a condition of registration that all independent manufacturing batches of
Comirnaty (BNT162b2 (mRNA)) COVID-19 vaccine to be supplied in Australia are not
released for supply by or on behalf of the sponsor until samples and the
manufacturer’s release data have been assessed by, and the sponsor has received
notification acknowledging authorisation to release from, the Laboratories Branch,
TGA.
In complying with the above, the sponsor must supply the following for each
independent batch of the product imported or proposed to be imported into Australia:
– A completed Request for Release Form, available from
xxxxxxxx@xxxxxx.xxx.xx ;
and
– complete summary protocols for manufacture and QC, including all steps in
production in the agreed format; and
– at least 20 (twenty) vials (samples) of each manufacturing batch of
BNT162b2(mRNA) COVID-19 vaccine with the Australian labels, PI and packaging
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 40 of 42
FINAL 25 January 2021
link to page 14
Therapeutic Goods Administration
(unless an exemption to supply these has been granted) representative of all
batches of product proposed to be distributed in Australia; and
– if the manufacturing batch has been released in Europe or United Kingdom (UK) a
copy of the EU Official Control Authority Batch Release (OCABR) certificate (or
equivalent from the UK) must also be provided; and
– any reagents, reference material and standards required to undertake testing as
requested by Laboratories Branch, TGA.
•
Certified Product Details
An electronic copy of the Certified Product Details (CPD) as described in Guidance 7:
Certified Product Details of the Australian Regulatory Guidelines for Prescription
Medicines (ARGPM
) https://www.tga.gov.au/guidance-7-certified-product-details
should be provided upon registration of the therapeutic good. In addition, an updated
CPD, for the above products incorporating the approved changes is to be provided
within one month of the date of approval letter. A template for preparation of CPD for
biological prescription medicines and Vaccines can be obtained from the TGA website
https://www.tga.gov.au/form/certified-product-details-cpd-biological-prescription-
medicines . The CPD should be sent as a single bookmarked PDF document to
xxxxxxxx@xxxxxx.xxx.xx as soon as possible after registration/approval of the product
or any subsequent changes as indicated above.
•
Post approval quality commitments
As a provisionally registered medicine, extensive post-approval commitments are
required of the sponsor. The additional requested quality data and notifications to the
TGA should be provided as post approval commitments. This includes the following
commitments:
– Commitment is required from the sponsor that they maintain the validity of all
manufacturer Good Manufacturing Practice (GMP) clearances for the duration of
product supply to Australia. Additionally, that adherence to the conditions of GMP
clearance approval is upheld.
– Additional data should be provided in relation to the reference standards and
materials.
– Additional stability data should be submitted as it becomes available. Once
additional data have been submitted to the TGA for evaluation, an extended shelf
life and/or change in storage conditions for the DS and/or DP may be considered.
– The sponsor must inform the TGA of any temperature deviation during shipment
and not supply product that has been exposed to a temperature excursion outside
of the approved storage conditions of -90°C to -60°C.
– Additional information should be provided regarding batch analyses.
– Additional data should be provided in relation to process validation of commercial
scale batches.
– Additional data should be provided for the proposed rapid sterility test.
– The requested leachables study data should be provide
d.17
Attachment 1. Product Information
The PI for Comirnaty approved with the submission which is described in this AusPAR is
at Attachment 1. For the most recent PI, please refer to the TGA website at
<https://www.tga.gov.au/product-information-pi>.
AusPAR – COMIRNATY - BNT162b2 (mRNA) - Pfizer Australia Pty Ltd - PM-2020-05461-1-2
Page 41 of 42
FINAL 25 January 2021
Therapeutic Goods Administration
PO Box 100 Woden ACT 2606 Australia
Email
: xxxx@xxx.xxx.xx Phone: 1800 020 653 Fax: 02 6232 8605
https://www.tga.gov.au
Document Outline










